
在温度t1和t2下,X2(g)和H2反应生成HX的平衡常数如下表:

(1)已知t2>t1, HX的生成反应是________反应(填“吸热”或“放热”)。
HX的生成反应是________反应(填“吸热”或“放热”)。
(2)HX的电子式是________。
(3)共价键的极性随共用电子对偏移程度的增大而增强,HX共价键的极性由强到弱的顺序是________。
(4)X2都能与H2反应生成HX,用原子结构解释原因:
________________________________________________________________________。
(5)K的变化体现出X2化学性质的递变性,用原子结构解释原因:________________________________________________________________________,
原子半径逐渐增大,得电子能力逐渐减弱。
(6)仅依据K的变化,可以推断出:随着卤素原子核电荷数的增加,________(选填字母)。
a.在相同条件下,平衡时X2的转 化率逐渐降低
化率逐渐降低
b.X2与H2反应的剧烈程度逐渐减弱
c.HX的还原性逐渐减弱
d.HX的稳定性逐渐减弱
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
W、X、Y、Z是原子序数依次增大的四种短周期元素。已知:①四种元素的电子层数之和等于10,且它们分别属于连续的四 个主族;②四种元素的原子中半径最大的是X原子。下列说法正确的是( )
个主族;②四种元素的原子中半径最大的是X原子。下列说法正确的是( )
A.W和X位于第二周期
B.Y和Z分别是Al和Si
C.W和X分别是H和Mg
D.Z的金属性可能比X的金属性强
查看答案和解析>>
科目:高中化学 来源: 题型:
L-多巴是一种有机物,它可用于帕金森综合症的治疗,其结构简式为:
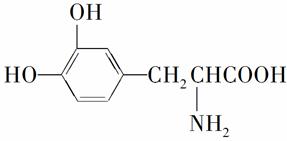 ,这种药物的研制是基于获得2000年诺贝尔生理学或医学奖和获得2001年诺贝尔化学奖的研究成果。下列关于L-多巴酸碱性的叙述正确的是( )
,这种药物的研制是基于获得2000年诺贝尔生理学或医学奖和获得2001年诺贝尔化学奖的研究成果。下列关于L-多巴酸碱性的叙述正确的是( )
A.既没有酸性,又没有碱性
B.既具有酸性,又具有碱性
C.只有酸性,没有碱性
D.只有碱性,没有酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于化学键的说法正确的是( )
①原子间的相互作用叫化学键
②两个非金属原子间不可能形成离子键
③强电解质中一定存在离子键
④形成化学键的过程是能量降低的过程
⑤单质、共价化合物、离子化合物中都存在共价键
A.①④ B.③④
C.②③ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于化合物的说法正确的是( )
A.只含有共价键的化合物一定是共价化合物
B.由两种原子组成的纯净物一定是化合物
C.共价化合物熔化时破坏共价键
D.熔化状态下不导电的化合物一定是共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中正确的是 ( )
A.1mol任何纯净物都含有相同的分子数 B.1molO2中约含有6.02×1023个氧分子
C.1mol氢中含有2mol氢原子 D.阿伏加德罗常数就是6.02×1023mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
小明体检的血液化验单中,葡萄糖为5.9 mmol/L。表示该体检指标的物理量是( )。
A.溶解度(s) B.物质的量浓度(c) C.质量分数 D.摩尔质量(M)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列与化学反应能量变化相关的叙述正确的是( )
A.生成物总能量一定低于反应物总能量
B.放热反应的反应速率总是大于吸热反应的反应速率
C.应用盖斯定律,可计算某些难以直接测量的反应焓变
D.同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com