
有机物A只含C、H、O三种元素,其相对分子质量为76.为测定A的化学式,取3.8克的A置于密闭容器中完全燃烧,将燃烧产物通过盛有浓硫酸的试剂瓶,试剂瓶增重3.6克,继续通过盛有饱和氢氧化钠溶液的试剂瓶,试剂瓶增重6,6克.
(1)A的分子式为 ;
(2)A只含有一种官能团,且红外光谱图如图1: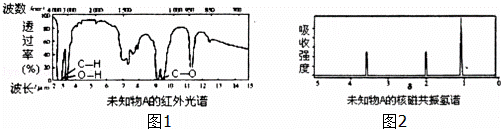
据此推断A可能的结构简式为:(已知:同一个碳原子上连接两个羟基是不稳定的结构)
, ;
(3)若A的核磁共振氢谱只有三个吸收峰,请写出A与足量金属钠反应的化学方程式: ;
请写出A与氧气(加热,铜做催化剂)反应的化学方程式: .
考点: 有关有机物分子式确定的计算.
专题: 有机物的化学性质及推断.
分析: (1)通过浓硫酸增重3.6g是水的质量,饱和氢氧化钠溶液增重6.6克是生成二氧化碳的质量,根据n=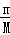 计算水、二氧化碳的物质的量,再根据原子守恒计算C原子、氢原子的物质的量,根据m=nM计算C原子、氢原子的质量,进而计算有机物中O原子的质量,根据n=
计算水、二氧化碳的物质的量,再根据原子守恒计算C原子、氢原子的物质的量,根据m=nM计算C原子、氢原子的质量,进而计算有机物中O原子的质量,根据n=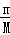 计算氧原子的物质的量,确定最简式,结合相对分子质量计算该有机物的分子式.
计算氧原子的物质的量,确定最简式,结合相对分子质量计算该有机物的分子式.
(2)红外光谱显示A分子中只有“C﹣C”键、“C﹣H”键和“O﹣H”键的振动吸收,据此结合有机物的分子式,推断A可能的结构简式;
(3)A的核磁共振氢谱只有三个吸收峰,分子中含有3种H原子,据此结合A的分子式与红外光谱确定A的结构,书写方程式.
解答: 解:(1)通过浓硫酸增重3.6g是水的质量,水的物质的量为: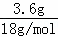 =0.2mol,故n(H)=2×0.2mol=0.4mol,m(H)=0.4mol×1g/mol=0.4g,饱和氢氧化钠溶液增重6.6克是生成二氧化碳的质量,二氧化碳的物质的量为:
=0.2mol,故n(H)=2×0.2mol=0.4mol,m(H)=0.4mol×1g/mol=0.4g,饱和氢氧化钠溶液增重6.6克是生成二氧化碳的质量,二氧化碳的物质的量为: =0.15mol,故n(C)=0.15mol,m(C)=0.15mol×12g/mol=1.8g,故有机物A中m(O)=3.8g﹣0.4g﹣1.8g=1.6g,故n(O)=
=0.15mol,故n(C)=0.15mol,m(C)=0.15mol×12g/mol=1.8g,故有机物A中m(O)=3.8g﹣0.4g﹣1.8g=1.6g,故n(O)= =0.1mol,所以n(C):n(H):n(O)=0.15mol:0.4mol:0.1mol=3:8:2,最简式为C3H8O2,该最简式中H原子已经达到饱和,则其最简式即为分子式,
=0.1mol,所以n(C):n(H):n(O)=0.15mol:0.4mol:0.1mol=3:8:2,最简式为C3H8O2,该最简式中H原子已经达到饱和,则其最简式即为分子式,
故答案为:C3H8O2;
(2)根据图示可知,红外光谱显示A分子中只有“C﹣C”键、“C﹣H”键和“O﹣H”键的振动吸收,同一个碳原子上连接两个羟基不稳定
故符合结构特征的有机物A的结构简式为:CH3CH(0H)CH2OH CH2(OH)CH2CH2OH,
故答案为:CH3CH(0H)CH2OH、CH2(OH)CH2CH2OH;
(3)A的核磁共振氢谱只有三个吸收峰,分子中含有3种H原子,结合有机物A的红外光谱可知,A为CH2(OH)CH2CH2OH,A与足量金属钠反应的化学方程式为:CH2(OH)CH2CH2OH+2Na→NaOCH2CH2CH2ONa+H2↑;
A与氧气(加热,铜做催化剂)反应的化学方程式:CH2(OH)CH2CH2OH+O2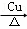 OHCCH2CHO+2H2O,
OHCCH2CHO+2H2O,
故答案为:CH2(OH)CH2CH2OH+2Na→NaOCH2CH2CH2ONa+H2↑;CH2(OH)CH2CH2OH+O2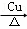 OHCCH2CHO+2H2O.
OHCCH2CHO+2H2O.
点评: 本题考查有机物分子式、结构简式的确定,题目难度中等,利用原子守恒确定有机物的分子式是解题的关键,注意掌握燃烧法沉淀有机物最简式的原理.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
按以下实验方案可以从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物.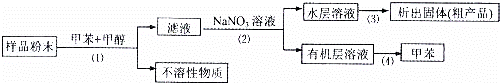
下列说法错误的是( )
A. 步骤(1)需要过滤装置 B. 步骤需要用到分液漏斗
C. 步骤(3)需要用到坩埚 D. 步骤(4)需要蒸馏装置
查看答案和解析>>
科目:高中化学 来源: 题型:
现有常温下的六份溶液:
①0.01mol • L﹣1 CH3COOH溶液;
②0.01mol • L﹣1 HCl溶液;
③pH=12的氨水;
④ pH=12的NaOH溶液;
⑤0.01mol • L﹣1 CH3COOH溶液与pH=12的氨水等体积混合后所得溶液;
⑥0.01mol • L﹣1 HCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
(1)其中水的电离程度最大的是________(填序号,下同),水的电离程度相同的是________。
(2)若将②③混合后所得溶液的pH=7,则消耗溶液的体积:②________③(填“>”“<”或“=“)。
(3)将六份溶液同等稀释10倍后,溶液的pH:①________②,③________④,⑤________⑥(填“>”“<”或“=“)。
(4)将①④混合,若有c(CH3COO-)>c(H+),则混合溶液可能呈________(填序号)。
A.酸性 B.碱性 C.中性
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质的沸点按由高到低的顺序排列正确的是( )
①CH3(CH2)2CH3 ②CH3(CH2)3CH3 ③(CH3)3C CH3 ④(CH3)2CHCH2CH3.
A. ②④①③ B. ④②①③ C. ④③②① D. ②④③①
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E是同一周期的五种主族元素,A和B的最高价氧化物对应的水化物均呈碱性,且碱性B>A,C和D的气态氢化物的稳定性C>D;E是这五种元素中原子半径最小的元素,则它们的原子序数由小到大的顺序是( )
|
| A. | A、B、C、D、E | B. | E、C、D、B、A | C. | B、A、D、C、E | D. | C、D、A、B、E |
查看答案和解析>>
科目:高中化学 来源: 题型:
具有下列电子排布式的原子中,半径最大的是( )
|
| A. | 1s22s22p63s23p3 | B. | 1s22s22p3 |
|
| C. | 1s22s22p2 | D. | 1s22s22p63s23p2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
如表为长式周期表的一部分,其中的序号代表对应的元素.
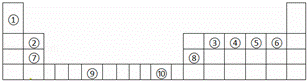
(1)写出上表中元素⑤的轨道表示式 ,元素⑨原子的核外电子排布式 .
(2)元素第一电离能的大小比较:④ ⑤(填写“>”“=”或“<”,下同);元素电负性的大小比较:④ ⑤(填写“>”“=”或“<”);请写出与元素④的单质互为等电子体的一种微粒的化学式 .
(3)在测定元素①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是 .
(4)上述③与④元素组成的(CN)2化合物中σ键与π键之比 .
(5)⑦的氧化物是优良的耐高温材料,它的熔点比CaO高,其原因是 .
(6)元素⑩的某种氧化物的晶体结构如图所示,其中实心球表示元素⑩原子,则该氧化物的化学式 .
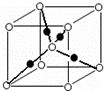
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com