
【题目】下列与化工生产相关描述不合理的是
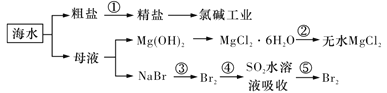
A.在合成氨工业中,低温、高压有利于提高合成氨平衡产率
B.在上图海水的综合利用中![]() 均为氧化还原反应
均为氧化还原反应
C.硫酸工业的基本流程:FeS2![]() SO2
SO2![]() SO3
SO3![]() H2SO4
H2SO4
D.可以采用如下方法制备硅:二氧化硅和适量的炭粉混合,高温反应得到粗硅,利用粗硅和氯气反应,其产物在高温下被氢气还原,从而得到较纯的硅
科目:高中化学 来源: 题型:
【题目】常温下,将1mLpH=2的一元酸HA溶液加水稀释至100mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是
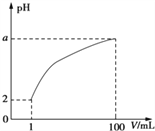
A. 加热HA溶液时,溶液酸性增强
B. lmol/LHA溶液与1mol/LNaOH溶液等体积混合,若所得溶液中c(Na+)>c(A-),则2<a<4
C. 某浓度的NaA溶液的pH=d,则其中由水电离出的c(OH-)=1014-d
D. HA溶液与NaOH溶液恰好完全反应时,一定有c(Na+)>c(A-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,用蒸馏水稀释1 mol/L氨水至0.01 mol/L,随溶液的稀释,下列各项中始终保持增大趋势的是( )
A.![]() B.c(H+)·c(OH-)
B.c(H+)·c(OH-)
C.![]() D.c(OH-)
D.c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得到的结论正确的是![]()
![]()
选项 | 实验操作 | 实验现象 | 结论 |
A | 向足量含KSCN的 | 溶液变黄 | 还原性:Fe2+>Br- |
B | 向2mL浓度为 | 开始出现白色沉淀,后出现黄色沉淀 |
|
C | 取等质量的Al和Fe,分别与足量的稀硫酸反应 | Al产生的氢气多 | 金属性: |
D | 向苯酚浊液中滴加饱和 | 浊液变澄清 | 酸性:苯酚 |
A.AB.B/span>C.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】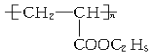 对此聚合物分析正确的是( )
对此聚合物分析正确的是( )
A. 其单体是CH2=CH2和HCOOC2H5
B. 它是缩聚反应产物
C. 其单体是CH2=CH-COOC2H5
D. 其链节是CH3CH2-COOC2H5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国高铁、航空航天、手机制造等都已经跻身世界一流水平,根据下列材料的应用回答问题。
应用 | “复兴号”高铁车轮 | “鲲龙”水陆两栖飞机零部件 | 华为折叠手机屏幕 |
用到的材料 | 高速钢 | 钛合金、铝合金 | 聚酰亚胺塑料 |
(1)上述材料中属于有机合成材料的是______,属于金属材料的是______(写一种即可)。
(2)飞机外壳用钛合金、铝合金的优点是______。
(3)在对高铁钢轨中的缝隙进行焊接时,常用铝和氧化铁在高温条件下反应生成熔融状态下的铁和另一种氧化物。写出该反应的化学方程式为______,反应基本类型是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组查阅资料得知:碘化钠是白色晶体无嗅,味咸而微苦,在空气和水溶液中逐渐析出碘而变黄或棕色。工业上用NaOH溶液、水合肼制取碘化钠固体,其制备流程图如下,有关说法不正确的是( )
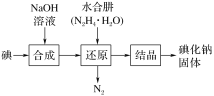
已知:N2H4·H2O在100℃以上分解。
A.已知在合成过程的反应产物中含有NaIO3,若合成过程中消耗了3mol I2,最多能生成NaIO3的物质的量为1 mol
B.上述还原过程中主要的离子方程式为2IO3-+3N2H4·H2O=2I-+3N2+9H2O
C.为了加快反应速率,上述还原反应最好在高温条件下进行
D.工业上也可以用硫化钠或铁屑还原碘酸钠制备碘化钠,但水合肼还原法制得的产品纯度更高,因产物是N2和H2O,没有其他副产物,不会引入杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种元素X、Y、Z、W位于元素周期表的前四周期,已知它们的核电荷数依次增加,且核电荷数之和为51;Y原子的L层p轨道中有2个电子;Z与Y原子的价层电子数相同;W原子的L层电子数与最外层电子数之比为4∶1,其d轨道中的电子数与最外层电子数之比为5∶1。
(1)Y、Z可分别与X形成只含一个中心原子的共价化合物a、b,它们的分子式分别是________、________;杂化轨道分别是________、________;a分子的立体结构是________。
(2)Y的最高价氧化物和Z的最高价氧化物的晶体类型分别是________晶体、________晶体。
(3)Y与Z比较,电负性较大的是________,W2+离子的核外电子排布式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水浴加热滴加酚酞的NaHCO3溶液,颜色及pH随温度变化如下(忽略水的挥发):
时间 | ① | ② | ③ | ④ | ⑤ |
温度/℃ | 20 | 30 | 40 | 从40℃冷却到20℃ | 沸水浴后冷却到20℃ |
颜色变化 | 红色略加深 | 红色接近① | 红色比③加深较多 | ||
pH | 8.31 | 8.29 | 8.26 | 8.31 | 9.20 |
下列说法不正确的是( )
A.NaHCO3溶液显碱性的原因:HCO3-+H2O![]() H2CO3+OH-
H2CO3+OH-
B.①→③的过程中,颜色加深的原因可能是HCO3-水解程度增大
C.①→③的过程中,pH略微下降说明升温过程中c(OH-)减小
D.⑤比①pH增大,推测是由于NaHCO3分解生成的Na2CO3的缘故
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com