
【题目】在恒容密闭容器中合成甲醇;CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
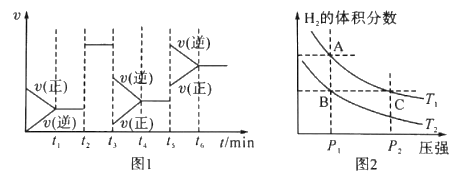
(1)图1中t3时刻改变的条件是____,t5时刻改变的条件是____.
(2)判断反应达到化学平衡状态的依据是____(填序号)。
a.生成CH3OH的速率与消耗CO的速率相等
b.混合气体的密度不变
c.混合气体的总物质的量不变
d.CH3OH、CO、H2的浓度都不再发生变化
(3)如图2表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、B两点的反应速率:A____B(填“>”“;”或“<”,下同),A、C两点的化学平衡常数:A____C。
(4)恒容条件下,下列措施中能使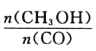 增大的有_____。
增大的有_____。
A.升高温度 B.充入He气 C.使用催化剂 D.再充入1molCO和2moIH2
(5)在某温度下,容积均为2L的三个密闭容器中-按不同方式投入反应物。初始投料与各容器达到平衡时的有关数据如下:

下列说法正确的是____(填字母)。
A.在该温度下,甲容器中从反应开始到平衡所需时间为4min,则v(H2)为0.25 mol/(L·min)
B.转化率:α3 >α1,平衡时n(CH3OH):n3>1.0mol
C.丙容器中,平衡后将容器的容积压缩到原来的1/2,平衡常数K增大
D.体系的压强:p3<2p1=2P2
【答案】 减小压强 升高温度 cd > = D B、D
【解析】(1)结合图1,t5-t6时化学平衡逆向移动,反应速率加快,应该是升高温度的缘故,可逆反应CO(g)+2H2(g)![]() CH3OH(g)。△H<0,该反应为体积减小的放热反应,改变反应条件,平衡移动,根据各时刻的速率变化、反应的方向判断即可。(2)达到平衡状态时,正逆反应速率相等,各物质的浓度不变,百分含量不变,以及由此衍生的其它一些量不变,据此分析;(3)平衡常数是温度的函数;(4)利用平衡原理进行分析;(5)A、根据v=△c/△t计算v(H2);B、甲、乙为完全等效平衡,平衡时对应各组分的物质的量相等,丙与甲相比,可以等效为在甲的基础上,压强增大一倍,平衡向正反应移动,平衡时混合气体的物质的量小于甲中的2倍;C、温度不变,平衡常数不变;D、甲、乙为等效平衡,平衡时对应各组分的物质的量相等,二者压强相等,丙与甲相比,可以等效为在甲的基础上,压强增大一倍,平衡向正反应移动,平衡时混合气体的物质的量小于甲中的2倍;
CH3OH(g)。△H<0,该反应为体积减小的放热反应,改变反应条件,平衡移动,根据各时刻的速率变化、反应的方向判断即可。(2)达到平衡状态时,正逆反应速率相等,各物质的浓度不变,百分含量不变,以及由此衍生的其它一些量不变,据此分析;(3)平衡常数是温度的函数;(4)利用平衡原理进行分析;(5)A、根据v=△c/△t计算v(H2);B、甲、乙为完全等效平衡,平衡时对应各组分的物质的量相等,丙与甲相比,可以等效为在甲的基础上,压强增大一倍,平衡向正反应移动,平衡时混合气体的物质的量小于甲中的2倍;C、温度不变,平衡常数不变;D、甲、乙为等效平衡,平衡时对应各组分的物质的量相等,二者压强相等,丙与甲相比,可以等效为在甲的基础上,压强增大一倍,平衡向正反应移动,平衡时混合气体的物质的量小于甲中的2倍;
(1)由图1可知,t2-t3时为平衡状态,正逆反应物速率相等,反应速率增大,但化学平衡不移动,应为催化剂对化学反应的影响,t3-t4阶段速率减慢,平衡逆向进行,应该是减小压强导致,t5-t6时化学平衡逆向移动,反应速率加快,应该是升高温度的缘故。(2)a.生成CH3OH的速率与消耗CO的速率相等,均为正速率,故A错误;b.容器内混合气体的总质量不变,容器的容积不变,容器内气体密度始终不发生变化,故错误;c.反应是前后气体体积变小的反应,混合气体的总物质的量不变,说明化学平衡不再发生移动,达到化学平衡状态,故c正确;d.CH3OH、CO、H2的浓度都不再发生变化,达到平衡状态,故d正确;故选cd。(3)图2表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,压强相同时,A点氢气的体积分数,温度高,A、B两点的反应速率:A>B,A、C在等温曲线,故A、C两点的化学平衡常数相等:A=C。(4)恒容条件下,A.升高温度平衡逆向移动,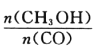 减小,故A错误; B.充入He气,平衡不移动,
减小,故A错误; B.充入He气,平衡不移动,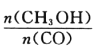 不变,故B错误; C.使用催化剂,平衡不移动,故C错误;D.再充入1molCO和2moIH2,反应正向进行,
不变,故B错误; C.使用催化剂,平衡不移动,故C错误;D.再充入1molCO和2moIH2,反应正向进行,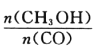 增大,故D正确;故选D。(5)A.在该温度下,甲容器中从反应开始到平衡所需时间为4min,由反应CO(g)+2H2(g)
增大,故D正确;故选D。(5)A.在该温度下,甲容器中从反应开始到平衡所需时间为4min,由反应CO(g)+2H2(g)![]() CH3OH(g),生成0.5molCH3OH消耗1molH2,则v(H2)=
CH3OH(g),生成0.5molCH3OH消耗1molH2,则v(H2)=![]() 0.125 mol/(L·min),故A错误;B.甲、乙为等效平衡,平衡时对应各组分的物质的量相等,丙与甲相比,可以等效为在甲的基础上,压强增大一倍,平衡向正反应移动,平衡时混合气体的物质的量小于甲中的2倍,故n2=0.5,α3 >α1,n3>1.0mol,故B正确;C.温度不变,平衡常数不变,丙容器中,平衡后将容器的容积压缩到原来的1/2,平衡常数K不变,故C错误;D.甲、乙为等效平衡,平衡时对应各组分的物质的量相等,二者压强相等,丙与甲相比,可以等效为在甲的基础上,压强增大一倍,平衡向正反应移动,平衡时混合气体的物质的量小于甲中的2倍,故压强P3<2P1=2P2 ,故D正确;故选BD。
0.125 mol/(L·min),故A错误;B.甲、乙为等效平衡,平衡时对应各组分的物质的量相等,丙与甲相比,可以等效为在甲的基础上,压强增大一倍,平衡向正反应移动,平衡时混合气体的物质的量小于甲中的2倍,故n2=0.5,α3 >α1,n3>1.0mol,故B正确;C.温度不变,平衡常数不变,丙容器中,平衡后将容器的容积压缩到原来的1/2,平衡常数K不变,故C错误;D.甲、乙为等效平衡,平衡时对应各组分的物质的量相等,二者压强相等,丙与甲相比,可以等效为在甲的基础上,压强增大一倍,平衡向正反应移动,平衡时混合气体的物质的量小于甲中的2倍,故压强P3<2P1=2P2 ,故D正确;故选BD。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ现有下列五种有机物:①CH4、②CH2=CH2、③CH3CH2OH、④ CH3 CH2CH2 CH3 、⑤CH3COOH请回答:
(1)写出⑤的官能团的名称______。(2)与①互为同系物的是______(填序号)。
Ⅱ.下表是A、B、C三种有机物的有关信息:
A | ①能使溴的四氧化碳溶液褪色;②比例模型为: ③能与水在一定条件下反应生成C |
B | ①由C、H、O三种元素组成;②球棍模型为 |
C | ①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应; ③能与B反应生成相对分子质量为86的酯 |
请结合信息回答下列问题:
(1)A与氢气发生加成反应后生成物质D,写出符合下列要求的有机物的结构简式:_______。
①与D互为同系物 ②分子中碳原子总数是4 ③分子里带有一个支链
(2)对于物质B有关说法正确的是_____ (填序号) 。
①无色无味液体 ②有毒 ③易溶于水 ④具有酸性,能与碳酸钙反应 ⑤官能团是-OH
(3)下列试剂中,能用于检验C中是否含有水的是______ (填序号)。
①CuSO4·5H2O ②无水硫酸铜 ③浓硫酸 ④金属钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物E是一种医药中间体,常用于制备抗凝血药,可以通过如图所示的路线合成: 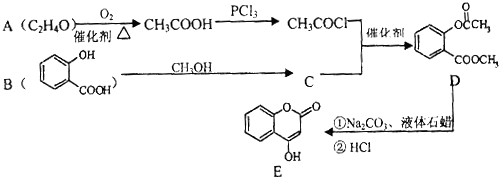
(1)A中含有的官能团名称为 .
(2)C转化为D的反应类型是 .
(3)写出D与足量NaOH溶液完全反应的化学方程式: .
(4)1mol E最多可与mol H2加成.
(5)写出同时满足下列条件的B的一种同分异构体的结构简式: . A.能发生银镜反应
B.核磁共振氢谱只有4个峰
C.能与FeCl3溶液发生显色反应
D.水解时每摩尔可消耗3mol NaOH
(6)已知工业上以氯苯水解制取苯酚,而酚羟基一般不易直接与羧酸酯化.苯的同系物可以被酸性KMnO4溶液氧化: ![]() 苯甲酸苯酚酯
苯甲酸苯酚酯 ![]() 是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).
是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).
合成路线流程图示例如下:H2C=CH2 ![]() CH3CH2Br
CH3CH2Br ![]() CH3CH2OH.
CH3CH2OH.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组称取纯净的Na2SO3 ·7H20 a克,隔绝空气加强热至恒重,经过分析与计算,得到的固体质量与全部转化为亚硫酸钠固体的计算值一致,但固体在水中溶解后测的pH值比理论计算值(相同浓度Na2SO3溶液的pH)大很多。下列说法不正确的是
A. 连续两次称量强热前后固体的质量,如质量差小于0.1g,即可判断固体已经恒重
B. 产生上述矛盾的可能解释:4Na2SO3 ![]() 3Na2SO4 + Na2S
3Na2SO4 + Na2S
C. 固体产物中加入稀盐酸可能有淡黄色沉淀产生
D. 加入BaCl2溶液,出现白色沉淀,则能确定产物中有Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生石灰是常用的建筑材料,常采用煅烧石灰石来制取。体积为1L的真空密闭容器中加入0.5moL碳酸钙,发生的反应CaCO3(s)![]() CaO(s)+CO2(g)△H ,测得二氧化碳的物质的量浓度随温度变化关系如图所示。
CaO(s)+CO2(g)△H ,测得二氧化碳的物质的量浓度随温度变化关系如图所示。
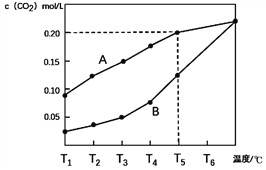
图A表示CO2的平衡浓度随温度变化的关系曲线
图B表示不同温度下反应经过相同时间时CO2的物质的量浓度的变化曲线
回答下列相关问题:
(1)CaCO3(s)![]() CaO(s)+CO2(g) △H ____ 0(填>,<或=)。
CaO(s)+CO2(g) △H ____ 0(填>,<或=)。
(2)在T5℃下,维持温度和容器体积不变,向上述平衡体系再充入0.5moL氮气,则最后的平衡时容器中的碳酸钙质量为____克;若在T5℃下,维持温度和总压强不变,向原平衡体系再充入0.5moL氮气,则容器中最后残留的碳酸钙质量为____克。
(3)请说明随着温度升高,曲线B向曲线A逼近的原因____
(4)以CaO为吸收体,将生物材质(以C计)与水蒸气反应制取H2。
相关主要反应如下:
I. C(s) + H2O(g)![]() CO(g) + H2(g) △H = + 131. 6 kJ·mol-1
CO(g) + H2(g) △H = + 131. 6 kJ·mol-1
II. CO(g) + H2O(g)![]() CO2(g) + H2(g) △H = -43 kJ·mol-1
CO2(g) + H2(g) △H = -43 kJ·mol-1
III. CaO(s)+CO2(g)![]() CaCO3(s) △H = -178. 3 kJ·mol-1
CaCO3(s) △H = -178. 3 kJ·mol-1
①计算反应Ⅳ C(s) + 2H2O(g) + CaO(s)![]() CaCO3(s) + 2H2 (g)的△H =____kJ·mol-1。
CaCO3(s) + 2H2 (g)的△H =____kJ·mol-1。
若K1、K2、K3分别为反应I、II、III的平衡常数,则反应Ⅳ的平衡常数K=____
(用含K1、K2、K3的式子表示)。
②对于可逆反应 C(s)+2H2O(g)+CaO(s)![]() CaCO3(s) + 2H2(g),采取以下措施可以提高H2产率的是____。(填字母编号)
CaCO3(s) + 2H2(g),采取以下措施可以提高H2产率的是____。(填字母编号)
A. 适当的降低体系的温度 B. 压缩容器的体积
C. 用镧镍合金(LaNi5)吸收氢气 D. 增加CaO的量
(5)将碳酸钙固体与CO2饱和水溶液充分接触,某温度下CO2饱和水溶液中H2CO3的浓度0.03moL·L-1,水的pH约等于6,这种情况下钙离子最大浓度为____moL·L-1 。(计算结果保留两位有效数字)(CaCO3的KSP=2.8×10-9,碳酸K1=4.3×10-7 K2=4.7×10-11)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体酸燃料电池以CsHSO4固体为电解质传递H+ , 其基本结构见如图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是( ) 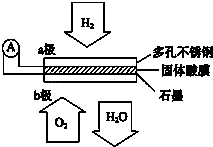
A.电子通过外电路从b极流向a极
B.b极上的电极反应式为:O2+2H2O+4e﹣=4OH﹣
C.每转移0.1 mol电子,消耗标准状况下1.12 L的H2
D.OH﹣由a极通过固体酸电解质传递到b极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在蒸馏实验中,下列叙述不正确的是( )
A.用锥形瓶来接收冷凝出的液体B.将温度计水银球插入蒸馏烧瓶中的液面下
C.冷水从冷凝管下口进入,上口流出D.加入沸石的作用是防止液体暴沸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《本草衍义》中对精制砒霜过程有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者次之。”文中涉及的操作方法是( )
A.燕馏B.过滤C.升华D.萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备 BaCl2·2H2O 有如下两种途径。
途径 1:以重晶石(主要成分 BaSO4)为原料,流程如下:
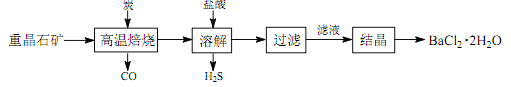
(1)写出“高温焙烧”时反应的化学方程式: _____________________________________。
(2)“高温焙烧” 时必须加入过量的炭,同时还要通入空气,其目的是____________。
途径 2:以毒重石(主要成分 BaCO3,含 Ca2+、 Mg2+、 Fe3+等杂质)为原料,流程如下:
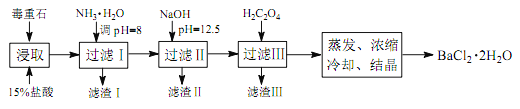
已知: Ksp(BaC2O4)=1.6×10-7, Ksp(CaC2O4)=2.3×10-9
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的 pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的 pH | 13.9 | 11.1 | 3.7 |
(3)为提高矿石的浸取率,可采取的措施是_________。
(4)加入 NH3·H2O 调节 pH=8 可除去____ (填离子符号),滤渣Ⅱ中含_________(填化学式)。加入 H2C2O4时应避免过量,原因是_________。
(5)重量法测定产品纯度的步骤为:
准确称取 m g BaCl2·2H2O 试样,加入 100 mL 水, 用 3 mL 2 mol·L-1 的 HCl 溶液加热溶解。边搅拌,边逐滴加入 0.1 mol·L-1 H2SO4 溶液。待 BaSO4 完全沉降后,过滤,用0.01 mol·L-1 的稀H2SO4洗涤沉淀 3~4 次,直至洗涤液中不含 Cl-为止。将沉淀置于坩埚中经烘干灼烧至恒重,称量为 n g。则BaCl2·2H2O的质量分数为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com