
【题目】工业上可由乙苯生产苯乙烯:![]() ,下列说法正确的是
,下列说法正确的是
A. 该反应的类型为消去反应
B. 乙苯的同分异构体共有三种
C. 可用酸性高锰酸钾溶液鉴别乙苯和苯乙烯
D. 乙苯和苯乙烯分子内共平面的碳原子数均为7
科目:高中化学 来源: 题型:
【题目】某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”.实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢,设计方案中一组数据如表:
编号 | H2C2O4溶液 | 酸性KMnO溶液 | 温度℃ | ||
浓度/(molL﹣1) | 体积/mL | 浓度/(molL﹣1) | 体积/mL | ||
① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4溶液转化为MnSO4 , 标况下,每生成89.6LCO2气体,转移mol电子.写出H2C2O4与酸性KMnO4溶液反应的离子方程式 .
(2)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=molL﹣1min﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组进行了有关Cu、硝酸、硫酸化学性质的实验,实验过程如下图所示。下列有关说法正确的是

A. 实验①中溶液呈蓝色,试管口有红棕色气体产生,说明稀硝酸被Cu还原为NO2
B. 实验③中滴加稀硫酸,铜片继续溶解,说明稀硫酸的氧化性比稀硝酸强
C. 实验③发生反应的化学方程式为:3Cu+Cu(NO3)2+4H2SO4=4CuSO4+2NO↑+4H2O
D. 由上述实验可得出结论:Cu在常温下既可以和稀硝酸反应,也可以和稀硫酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备1,2﹣二溴乙烷的反应原理如下:
CH3CH2OH  CH2=CH2
CH2=CH2
CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.
用少量的溴和足量的乙醇制备1,2﹣二溴乙烷的装置如图所示:
有关数据列表如下:
乙醇 | 1,2﹣二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/gcm﹣3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | ﹣116 |
回答下列问题:
(1)在此制各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入 , 其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)若产物中有少量副产物乙醚.可用的方法除去;
(4)反应过程中应用冷水冷却装置D,其主要目的是避免溴大量挥发,但又不能过度冷却(如用冰水),其原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y两元素可形成X2Y3型化合物,则X、Y原子最外层的电子排布可能是( )。
A. X:3s23p1Y:3s23p5 B. X:3s2Y:2s22p3
C. X:3s23p1Y:3s23p3 D. X:2s22p3Y:2s22p4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,人们对环境保护、新能源开发很重视。
(1)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体转化为无毒气体:4CO(g)+2NO2(g)![]() 4CO2(g)+N2(g),恒温恒容条件下,能够说明该反应已达到平衡状态的是________(填序号);
4CO2(g)+N2(g),恒温恒容条件下,能够说明该反应已达到平衡状态的是________(填序号);
A.容器内混合气体颜色不再变化 B.容器内的压强保持不变
C.2v逆(NO2)=v正(N2) D.容器内混合气体密度保持不变
(2)用活性炭还原法也可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH。在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g)+CO2(g) ΔH。在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
时间/min 浓度/( mol·L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①根据图表数据分析T1℃时,该反应在0~20 min的平均反应速率v(CO2)=________;计算该反应的平衡常数K=______。
②根据上表数据判断,由30 min到40 min时改变的条件可能是(任写一种)__________________。
③30 min后升高温度至T2℃,达到新平衡时,容器中NO、N2、CO2浓度之比为5∶3∶3,此时NO的转化率_______(填“升高”或“降低”),ΔH_____0(填“>”或“<”)。
(3)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-l59.5 kJ· mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) ΔH= +116.5 kJ· mol-1
③H2O(l)=H2O(g) ΔH=+44.0 kJ· mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式_____________________。
(4)科学家利用原电池原理,在酸性介质中将NO2转化为HNO3,则该转化的负极反应式为:_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器的名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.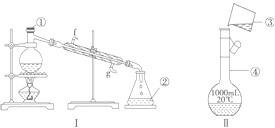
(1)写出下列仪器的名称:① , ②_,④ .
(2)若利用装置Ⅰ分离四氯化碳和酒精的混合物,还缺少的仪器有 , 将仪器补充完整后进行的实验操作的名称为;冷凝管的进水口是(填“f”或“g”);现需配制250mL 0.2mol/L NaCl溶液,装置Ⅱ是某同学转移溶液的示意图,图中的错误是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com