
| A. | 0.45g | B. | 0.54g | C. | 0.5g | D. | 0.35g |
分析 2.3gNa的物质的量为$\frac{2.3g}{23g/mol}$=0.1mol,由2 Na+2H2O=2NaOH+H2↑,可知生成NaOH为0.1mol,反应生成氢气总物质的量为$\frac{0.16g}{2g/mol}$=0.08mol,由2Al+2NaOH+2H2O=2NaAlO2+3H2↑可知,0.1molNaOH完全反应会生成0.15mol氢气,大于0.08mol,故Al完全反应、NaOH有剩余,根据电子转移守恒计算Al的物质的量,再根据m=nM计算Al的质量.
解答 解:2.3gNa的物质的量为$\frac{2.3g}{23g/mol}$=0.1mol,由2 Na+2H2O=2NaOH+H2↑,可知生成NaOH为0.1mol,反应生成氢气总物质的量为$\frac{0.16g}{2g/mol}$=0.08mol,由2Al+2NaOH+2H2O=2NaAlO2+3H2↑可知,0.1molNaOH完全反应会生成0.15mol氢气,大于0.08mol,故Al完全反应、NaOH有剩余,
根据电子转移守恒,0.1mol×1+3n(Al)=0.08mol×2,故n(Al)=0.02mol,
则铝箔的质量为0.02×27g/mol=0.54g,
故选:B.
点评 本题考查混合物计算、化学方程式计算,关键是判断Al与氢氧化钠溶液反应中氢氧化钠过量,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 单质碳具有还原性 | |
| B. | 木炭燃烧时吸收大量的热 | |
| C. | 用活性炭可除去硬水中的氯化钙杂质 | |
| D. | 金刚石、石墨都是由碳原子构成的,都很硬 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若将适量CO2 通入0.1 mol•L-1Na2CO3溶液中至溶液恰好呈中性,则溶液中(不考虑溶液体积变化) 2 c(CO32ˉ)+c(HCO3ˉ)=0.1 mol•L-1 | |
| B. | 在25℃时,将c mol•L-1的醋酸溶液与0.02 mol•L-1NaOH溶液等体积混合后溶液恰好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=$\frac{2×1{0}^{-9}}{c-0.02}$ | |
| C. | 常温下,将相同体积的pH=3硫酸和pH=11一元碱BOH溶液混合,所得溶液可能为中性也可能为碱性 | |
| D. | 等体积等物质的量浓度的NaClO溶液与NaCl溶液中离子总数大小:N前<N后 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | LiH与D2O反应,所得氢气的摩尔质量为4g/mol | |
| B. | 1mol LiAlH4在125℃完全分解,转移3mol电子 | |
| C. | LiH与水反应的化学方程式为:LiH+H2O=LiOH+H2↑ | |
| D. | LiH与中微粒半径r(Li+)>r(H-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 0℃ | 50℃ | 80℃ | |
| Ca(OH)2 | 0.173g | 0.13g | 0.094g |
| Ba(OH)2•8H2O | 1.64g | 13.2g | 101.4g |
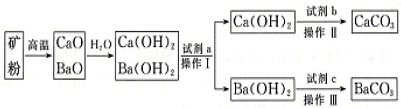
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(OH)2═Ca2++2OH- | B. | 酒精:CH3CH2OH═CH3CH2O-+H+ | ||
| C. | BaCl2═Ba2++Cl${\;}_{2}^{2-}$ | D. | H2SO4$\frac{\underline{\;通电\;}}{\;}$2H++SO${\;}_{4}^{2-}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com