
| A. | Q | B. | 2Q | C. | 3Q | D. | 4Q |
分析 利用生成的CO2用过量饱和石灰水完全吸收,可得200克CaCO3沉淀可计算出二氧化碳的物质的量,即得出二氧化碳的物质的量与放出的热量的关系,再利用完全燃烧1摩尔无水乙醇生成2摩尔二氧化碳来分析放出的热量.
解答 解:因生成的CO2用过量饱和石灰水完全吸收,可得200克CaCO3沉淀,
CaCO3的物质的量为$\frac{200g}{100g/mol}$=2mol,
由碳元素守恒可知,二氧化碳的物质的量也为2mol,
即生成1mol二氧化碳放出的热量为$\frac{Q}{2}$,
而完全燃烧1摩尔无水乙醇时生成2mol二氧化碳,
则放出的热量为$\frac{Q}{2}$×2=Q,
故选:A.
点评 本题考查学生利用化学反应中的元素守恒来分析二氧化碳的量及二氧化碳的量与放出的热量的关系,明确物质的物质的量与热量成正比是解答本题的关键.


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | CH3COOH溶液与NaOH溶液反应:H++OH-═H2O | |
| C. | 铁与稀硫酸反应:Fe+2H+═Fe2++H2↑ | |
| D. | 硫酸与Cu(OH)2反应:H++OH-═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
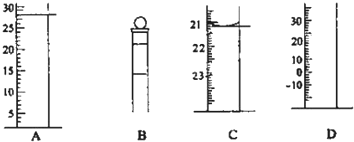
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某同学将电解池工作时电子、离子流动方向及电极种类等信息表示在如图中,下列有关分析完全正确的是
某同学将电解池工作时电子、离子流动方向及电极种类等信息表示在如图中,下列有关分析完全正确的是| A | B | C | D | |
| a电极 | 阳极 | 阴极 | 阳极 | 阴极 |
| d电极 | 正极 | 正极 | 负极 | 负极 |
| Q离子 | 阳离子 | 阳离子 | 阴离子 | 阴离子 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com