
分析 (1)HCl、CH3COOH都是一元酸,但HCl是强酸,醋酸是弱酸,HCl完全电离,醋酸只能部分电离,加入稀释,促进醋酸的电离;
(2)CH3OH---O2---KOH电池,负极发生氧化反应,甲醇被氧化,在碱性条件下生成碳酸根离子;
(3)电解饱和KI溶液,类似电解饱和食盐水,应生成碘、氢气和氢氧化钾.
解答 解:(1)体积相同,PH值均为2的盐酸和CH3COOH溶液,若分别加水稀释10倍,因稀释过程中醋酸进一步电离,则醋酸中氢离子浓度较大,pH较小,溶液的pH分别变成m和n,则m>n;如使稀释后的溶液pH相等,则应在醋酸中加入更多的水,则若分别加水稀释m倍、n倍,溶液的pH都变成3,则m与n的关系为m<n,
故答案为:m>n; m<n;
(2)CH3OH---O2---KOH电池,负极发生氧化反应,甲醇被氧化,在碱性条件下生成碳酸根离子,电极方程式为2CH3OH-12e-+16OH-=2CO32-+12H2O,
故答案为;2CH3OH-12e-+16OH-=2CO32-+12H2O;
(3)电解饱和KI溶液,类似电解饱和食盐水,应生成碘、氢气和氢氧化钾,电解方程式为2I-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+2OH-+I2,故答案为:2I-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+2OH-+I2.
点评 本题考查较为综合,涉及弱电解质的电离、原电池和电解池知识,侧重考查学生的分析能力,注意把握弱电解质的电离特点以及原电池、电解池的工作原理,把握电极方程式的书写,难度不大.


科目:高中化学 来源: 题型:选择题
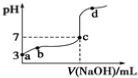
| A. | 由a点推知HA是弱酸 | B. | a、b点的溶液中,水的电离程度:a<b | ||
| C. | c点的溶液中:c(Na+)=c(A-)+c(HA) | D. | d点的溶液中:c(Na+)>c(A-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
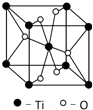 第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.
第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.| 元素 | Mn | Fe | |
| 电离能/kJ•mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | M点和N点对应的溶液均呈中性 | |
| B. | T1℃时,P点对应溶液中,水电离出来的c(H+)可能为10-4mol•K-1或10-10mol•L-1 | |
| C. | T2℃时,pH=11的NaOH溶液与pH=1的稀H2SO4等体积混合,所得溶液的pH=6 | |
| D. | 向某溶液中加入酸或碱,均可以使该溶液从M点转化为N点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有如图所示某有机物,根据该有机物的结构回答:
有如图所示某有机物,根据该有机物的结构回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 原子晶体 | 石墨 | 生石灰 | 碳化硅 | 金刚石 |
| 分子晶体 | 冰 | 固态氨 | 氯化铯 | 干冰 |
| 离子晶体 | 氮化铝 | 食盐 | 明矾 | 芒硝 |
| 金属晶体 | 铜 | 汞 | 铝 | 铁 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2SO4 | B. | KNO3 | C. | Ca(NO3)2 | D. | KIO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com