
【题目】SiO2是____________的酸酐,不溶于水。常温下和NaOH溶液反应的化学方程式为________;碱性试剂不能保存在______塞的试剂瓶中。高温下,SiO2和碱性氧化物(如CaO)反应的化学方程式为:_______;常温下SiO2和氢氟酸反应的化学方程式_______。
【答案】硅酸 SiO2+2NaOH=Na2SiO3+H2O 玻璃 SiO2+CaO![]() CaSiO3 SiO2+4HF=SiF4 ↑+2H2O
CaSiO3 SiO2+4HF=SiF4 ↑+2H2O
【解析】
酸酐是含氧酸脱去一分子水或几分子水后剩余的物质;常温下SiO2和NaOH溶液反应产生硅酸钠和水,硅酸盐有粘性,会将玻璃瓶与玻璃塞粘在一起,因此碱性试剂不能使用玻璃塞,要用橡胶塞或软木塞;SiO2是酸性氧化物,可以与碱性氧化物在高温下反应产生硅酸盐,可以与氢氟酸反应产生四氟化硅和水。
SiO2是H2SiO3脱去一分子水后剩余的物质,因此SiO2是硅酸的酸酐;在常温下SiO2和NaOH溶液反应生成硅酸钠和水,该反应的化学方程式为SiO2+2NaOH=Na2SiO3+H2O,所以二氧化硅是酸性氧化物;玻璃的主要成分是二氧化硅,二氧化硅与碱性试剂反应产生的硅酸盐具有粘性,会将玻璃瓶与玻璃塞粘在一起,因此碱性试剂不能保存在玻璃塞 的试剂瓶中;SiO2中Si、O原子间以共价键结合,断裂消耗很高的能量,CaO是离子化合物,Ca2+、O2-间以离子键结合,断裂为离子也需要很高的能量,因此在高温下,当SiO2、CaO获得足够能量时,会发生反应生成硅酸钙,反应的化学方程式为:SiO2+CaO![]() CaSiO3;常温下SiO2可以和氢氟酸反应产生SiF4、H2O,反应的化学方程式为SiO2+4HF=SiF4 ↑+2H2O。
CaSiO3;常温下SiO2可以和氢氟酸反应产生SiF4、H2O,反应的化学方程式为SiO2+4HF=SiF4 ↑+2H2O。


科目:高中化学 来源: 题型:
【题目】《汉书》中“高奴县有洧水可燃”,沈括在《梦溪笔谈》对“洧水”的使用有“予知其烟可用,试扫其烟为墨,黑光如漆,松墨不及也,此物必大行于世”的描述,对上文进行的某些分析中正确的是
A. “洧水”的主要成分是油脂
B. “洧水”的主要成分是煤油
C. 烟的主要成分是炭黑
D. 烟的主要成分是石墨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物I(C11H12O3)是制备液晶材料的中间体之一,其分子中含有醛基和酯基。I可以用E和H在一定条件下合成:
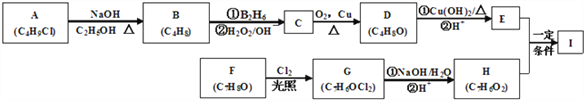
已知以下信息:
A的核磁共振氢谱表明其只有一种化学环境的氢;R—CH=CH2![]() R—CH2CH2OH
R—CH2CH2OH
化合物F苯环上的一氯代物只有两种;通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
请回答下列问题:
(1)C的化学名称为________________________。
(2)E的结构简式为______________________。
(3)A→B的反应类型为_________________、__________________;E+H→I的反应类型为_______________________。
(4)F生成G的化学方程式为____________________________________。
(5)E+H→I的化学方程式为___________________。
(6)I的同系物J比I相对分子质量小14,J的同分异构体中能同时满足如下条件:
①苯环上只有两个取代基;②既能发生银镜反应,又能与饱和NaHCO3溶液反应放出CO2,这样的同分异构体共有_______种(不考虑立体异构)。J的一种同分异构体发生银镜反应并酸化后核磁共振氢谱为三组峰,且峰面积比为2:2:1,写出J的这种同分异构体的结构简式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 铝合金是一种混合物,它比纯铝的熔点高
B. 电解熔融三氯化铝可生产金属金属铝
C. 水晶项链和餐桌上的瓷盘都是硅酸盐制品
D. 铜具有良好的导电性,常用来制作印刷电路板
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应 A(g) + 2B(g) ![]() 2C(g) ΔH<0,在一定条件下达到平衡,若改变条件,将变化结果(“增大”、“减小”或“不变”)填入空格。
2C(g) ΔH<0,在一定条件下达到平衡,若改变条件,将变化结果(“增大”、“减小”或“不变”)填入空格。
(1)升高温度,B的转化率_____________,v(正)____________,v(逆)____________。
(2)保持温度和压强不变,加入惰性气体,则C的物质的量_____________,A的转化率_____________。
(3) 保持温度和体积不变,加入惰性气体,A的转化率_____________。
(4)若温度和体积不变,反应从开始到平衡,容器内气体的密度_____________,压强____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(8分).氮化硅(Si3N4)是一种高温陶瓷材料,它的硬度大、熔点高、化学性质稳定,工业上普遍采用高纯硅与纯氮在1300℃反应获得。
(1)根据性质,推测氮化硅陶瓷的用途是 。
A.制汽轮机叶片 | B.制有色玻璃 | C.制永久性模具 | D.制造柴油机 |
(2)氮化硅陶瓷抗腐蚀能力强,除氢氟酸外,她不与其他无机酸反应。试推测该陶瓷被氢氟酸腐蚀的化学方程式为 。
(3)现用四氯化硅和氮气在氢气中加强热发生反应,可制得高纯度氮化硅,反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 烷烃的通式为CnH2n+2,随n值增大,碳元素的质量百分含量逐渐减小
B. 乙烯与溴加成反应的产物为溴乙烷
C. 1 mol苯恰好与3 mol氢气完全加成,说明苯分子中有三个碳碳双键
D. n=7,主链上有5个碳原子的烷烃共有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。微粒物质的量的变化如图所示。下列说法正确的是
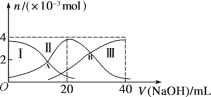
A. 当V(NaOH)=20 mL时,溶液中离子浓度关系:c(Na+)>c(HA-)>c(A2-)>c(H+)>c(OH-)
B. 当V(NaOH)=30 mL时,则有:2c(H+) + c(HA-) +2c(H2A) =c(A2-) +2c(OH-)
C. 向上述加入20 mL NaOH溶液后所得溶液中再加入水的过程中,pH减小
D. 若A、B两点对应的溶液pH值分别为a、b,则H2A![]() 2H++A2-的K=10-a-b
2H++A2-的K=10-a-b
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com