
| A、v(A)=0.5mol/(L?s ) |
| B、v(C)=6.0mol/(L?min) |
| C、v(B)=0.6mol/(L?s) |
| D、v(D)=0.4mol/(L?s) |
 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
| A、150 mL 1 mol?L-1 NaCl溶液 |
| B、75 mL 1 mol?L-1CaCl2溶液 |
| C、150 mL 0.2 mol?L-1 KCl溶液 |
| D、75 mL 1 mol?L-1AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、14g分子通式为CnH2n的链烃中含有的C═C的数目为
| ||
| B、标准状况下,NO和 O2各11.2L 混合,所得混合气体的分子总数为 0.75NA | ||
| C、25℃时,pH=7的NH4Cl和NH3?H2O混合溶液中,OH-离子数为10-7NA | ||
| D、两份2.7g铝分别与100mL浓度为2mol?L-1的盐酸和氢氧化钠溶液充分反应,转移的电子数均为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、熔点:F2<Cl2<Br2<I2 |
| B、微粒半径:F->Na+>Mg2+>Al3+ |
| C、酸性HClO4>H2SO4>H3PO4>H2SiO3 |
| D、热稳定性:HF<HCl<HBr<HI |
查看答案和解析>>
科目:高中化学 来源: 题型:
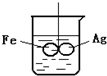 如图所示,在铁圈和银圈的焊接处,用一根棉线将其悬在盛水的烧杯中,使之平衡;小心的向烧杯中央滴入CuSO4溶液,片刻后可观察到的现象是( )
如图所示,在铁圈和银圈的焊接处,用一根棉线将其悬在盛水的烧杯中,使之平衡;小心的向烧杯中央滴入CuSO4溶液,片刻后可观察到的现象是( )| A、铁圈和银圈左右摇摆不定 |
| B、保持平衡状态 |
| C、铁圈向下倾斜,银圈向上倾斜 |
| D、银圈向下倾斜,铁圈向上倾斜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有共价键的化合物必是共价化合物 |
| B、吸热反应在不加热的条件下一定不能发生 |
| C、放热反应在常温下一定很容易发生 |
| D、双原子单质分子中的共价健一定是非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com