
分析 在一定温度下,10L恒容密闭容器中加入0.05molSO2、0.03molO2,经10min后反应达到平衡,测得c(SO3)=0.004mol/L,
2SO2(g)+O2(g)=2SO3(g)
起始浓度(mol/L):0.005 0.003 0
变化浓度(mol/L):0.004 0.002 0.004
平衡浓度(mol/L):0.001 0.001 0.004
(1)转化率=$\frac{浓度变化量}{起始浓度}$×100%;
若在原平衡的基础上再加入0.05molSO2、0.03molO2达到平衡时,等效再原平衡基础上增大压强,平衡正向移动;
(2)根据v=$\frac{△c}{△t}$计算v(SO2);
(3)恒温恒容下,压强之比等于混合气体总浓度之比;
(4)平衡时体系中SO3的百分含量=$\frac{三氧化硫浓度}{混合气体总浓度}$×100%;
(5)根据K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})×c({O}_{2})}$计算平衡常数,正反应为放热反应,升高温度,平衡逆向移动,平衡常数减小;
根据平衡时二氧化硫物质的量判断反应进行方向.
解答 解:在一定温度下,10L恒容密闭容器中加入0.05molSO2、0.03molO2,经10min后反应达到平衡,测得c(SO3)=0.004mol/L,
2SO2(g)+O2(g)=2SO3(g)
起始浓度(mol/L):0.005 0.003 0
变化浓度(mol/L):0.004 0.002 0.004
平衡浓度(mol/L):0.001 0.001 0.004
(1)SO2的转化率=$\frac{0.004mol/L}{0.005mol/L}$×100%=80%;
若在原平衡的基础上再加入0.05molSO2、0.03molO2达到平衡时,等效再原平衡基础上增大压强,平衡正向移动,SO2的转化率增大,
故答案为:80%;增大;
(2)v(SO2)=$\frac{0.004mol/L}{10min}$=4×10-4mol/(L.min),故答案为:4×10-4mol/(L.min);
(3)恒温恒容下,压强之比等于混合气体总浓度之比,故平衡时容器内气体压强与反应前的压强之比为0.006:0.008=2:3,故答案为:2:3;
(4)平衡时体系中SO3的百分含量=$\frac{0.004mol/L}{0.006mol/L}$×100%=66.7%,故答案为:66.7%;
(5)平衡常数K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})×c({O}_{2})}$=$\frac{0.00{4}^{2}}{0.001×0.001}$=16000;
正反应为放热反应,升高温度,平衡逆向移动,平衡常数减小;
平衡时二氧化硫物质的量为10L×0.001mol/L=0.01mol<0.02mol,故该反应向正反应移动,
故答案为:16000;减小;正向.
点评 本题考查化学平衡计算与影响因素、反应速率、平衡常数计算与影响因素等,掌握三段式在化学平衡计算中应用.


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
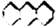 .其二氯代物的同分异构体共有(不考虑立体异构)( )
.其二氯代物的同分异构体共有(不考虑立体异构)( )| A. | 14种 | B. | 15种 | C. | 16种 | D. | 17种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数为17、中子数为20的氯(Cl)原子:${\;}_{17}^{20}$Cl | |
| B. | CO2电子式: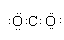 | |
| C. | 镁离子的结构示意图: | |
| D. | CCl4分子的比例模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铝溶液中加人过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 澄清石灰水与过量小苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| C. | 向1molFeBr2溶液中通入 1.5molCl2 :2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| D. | 氯化亚铁溶液中通人氯气:Fe2++Cl2═Fe3++2C1- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,8 g O2含有5NA个电子 | |
| B. | 1 L 1.0 mol•L-1NaAlO2溶液中含有氧原子数为2NA | |
| C. | 标准状况下,2.24 L CCl4中含有的分子数为0.1NA | |
| D. | 精炼铜的过程中,当阴极析出32 g铜时转移的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com