
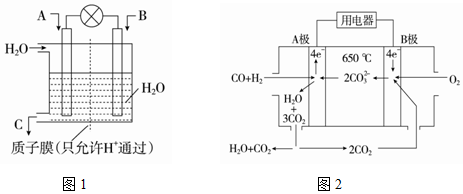
分析 (1)①燃料电池中,通入氧化剂的电极是正极、通入还原剂的电极是负极,该反应中C元素化合价由+2价变为-2价、H元素化合价由0价变为+1价,所以CO是氧化剂;
②若A为SO2,B为O2,C为H2SO4,负极上二氧化硫失电子和水反应生成硫酸根离子和氢离子;
③若A为NH3,B为O2,C为HNO3,则正极发生还原反应;
(2)①该燃料电池中,负极上一氧化碳、氢气失电子和碳酸根离子反应生成二氧化碳和水,由此书写电极反应式;
②依据消耗的氧气的量计算转移电子数,依据转移电子守恒,计算生成银的质量,根据消耗氢氧根计算氢离子浓度,从而计算pH;
解答 解:(1)①燃料电池中,通入氧化剂的电极是正极、通入还原剂的电极是负极,该反应中C元素化合价由+2价变为-2价、H元素化合价由0价变为+1价,所以CO是氧化剂,则通入CO的电极为正极,电极方程式为CO+4 e-+4H+=CH3OH,
故答案为:CO+4 e-+4H+=CH3OH;
②若A为SO2,B为O2,C为H2SO4,负极上二氧化硫失电子和水反应生成硫酸根离子和氢离子,电极反应式为SO2+2H2O-2e-=SO42-+4H+,
故答案为:SO2+2H2O-2e-=SO42-+4H+;
③若A为NO2,B为O2,C为HNO3,则正极发生还原反应,氧气得电子生成水,电极方程式为O2+4e-+4H+═2H2O,负极是NO2,发生氧化反应生成硝酸,电极反应式为:NO2-e-+H2O=NO3-+2H+,故答案为:NO2-e-+H2O=NO3-+2H+;
(2)①该燃料电池中,负极上一氧化碳、氢气失电子和碳酸根离子反应生成二氧化碳和水,电极反应式为:CO+H2-4e-+2CO32-=3CO2+H2O;
故答案为:CO+H2-4e-+2CO32-=3CO2+H2O;
②电解足量的硝酸银溶液,阳极为氢氧根失电子生成氧气,阴极上发生反应:Ag++e-=Ag,产物的质量为21.6g即0.2mol,转移电子是0.2mol,在阳极上:4OH--4e-=2H2O+O2↑,产生氧气的物质的量是0.05mol,体积是1.12L,则消耗氢氧根的物质的量为0.2mol,则溶液中属于氢离子为0.2mol,浓度为$\frac{0.2mol}{2L}$=1mol/L,所以溶液的pH为1;
故答案为:1.12;1.
点评 本题考查原电池设计、燃料电池等知识点,会根据电池反应式确定正负极及电解质,发生氧化反应的金属作负极、不如负极材料活泼的金属或导电的非金属作正极,发生还原反应的电解质为原电池中电解质,会正确书写电极反应式,为高考高频点.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 1molNH4+所含质子数为10 NA | |
| B. | 6.8g液态KHSO4中含有0.1NA个阳离子 | |
| C. | 常温常压下,22.4 LSO2所含的分子数为NA | |
| D. | 常温常压下,32 gO2和O3的混合气体所含原子数为 2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因铝表面能行成致密的氧化膜,所以铝制餐具可以长期使用 | |
| B. | 因废弃物易污染环境,腈纶不宜大量取代棉、麻等天然材料 | |
| C. | SiO2用途广泛,因其高熔点的特性成为光导纤维的主要原料 | |
| D. | 有机玻璃(聚甲基丙烯酸甲酯)是通过缩聚反应值得的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
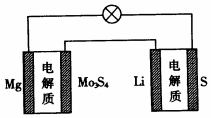 已知:镁电池的总反应为xMg+Mo3S4$?_{放电}^{充电}$MgxMo3S4,锂硫电池的总反应为2Li+S$?_{放电}^{充电}$Li2S.下列说法正确的是( )
已知:镁电池的总反应为xMg+Mo3S4$?_{放电}^{充电}$MgxMo3S4,锂硫电池的总反应为2Li+S$?_{放电}^{充电}$Li2S.下列说法正确的是( )| A. | 镁电池放电时,Mg2+向负极迁移 | |
| B. | 镁电池放电时,正极发生的电极反应为Mo3S4+2xe-=Mo3S42- | |
| C. | 理论上两种电池的比能量相同(参与电极反应的单位质量的电极材料放出电能的大小称为该电池的比能量) | |
| D. | 图中Li作负极,Mo3S4作阳极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 | B. | 0.05 | C. | K${\;}_{a1}^{θ}$(H2S) | D. | K${\;}_{{a}_{2}}^{θ}$(H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B. | C. | D. |
| 《神农本草经》记载,麻黄能“止咳逆上气” | 胃舒平药片 (复方氢氧化铝)  |  |  秦朝彩俑 |
| 古代中国人已用麻黄治疗咳嗽 | 该药是抗酸药,服用时喝些醋能提高药效 | 看到有该标志的丢弃物,应远离并报警 | 古代中国人掌握化学制颜料方法 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 棉花和蚕丝的主要成分都是纤维素 | |
| B. | 蛋白质在一定条件下发生水解反应生成葡萄糖 | |
| C. | 煤的气化是在高温下煤和水蒸气作用转化为可燃性气体的过程 | |
| D. | 合成材料的大量使用给人类带来了严重污染,所以要禁止生产和使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时正极反应为:VO2++2H++e-=VO2++H2O | |
| B. | 放电时每转移2mol电子时,消耗1mol氧化剂 | |
| C. | 充电过程中电子由阳极经导线移向阴极,再由阴极经电解质溶液移向阳极 | |
| D. | 放电过程中,H+由正极移向负极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com