
分析 (1)设出溶液体积都为1L,然后根据n=cV计算出盐酸和氢氧化钠的物质的量,再根据氢离子、氢氧根离子的物质的量判断过量,然后计算过量的酸或碱的物质的量浓度,最后计算溶液的pH;
(2)0.10mol•L-1HAc溶液与0.10mol•L-1NaOH溶液以3:2体积比混合,混合后为等浓度的乙酸、乙酸钠溶液;
(3)0.10mol•L-1HCl溶液与0.10mol•L-1NH3溶液以2:3体积比混合,混合后为等浓度的氯化铵、氨水溶液;
(4)0.10mol•L-1NaH2PO4溶液与0.10mol•L-1NaOH溶液以2:3体积比混合,混合后为等浓度的磷酸钠、氢氧化钠溶液.
解答 解:(1)设酸和碱的体积都是1L,0.10mol•L-1的HCl中c(H+)=0.10mol/L,0.1mol•L-1的NaOH中c(OH-)=0.1mol/L,以3:2体积比混合,混合后,混合溶液中c(H+)=$\frac{0.1×3-0.1×2}{5}$mol/L=0.02 mol/L,则混合溶液pH=-lg0.02=2-lg2≈1.699,
答:0.10mol•L-1HCl溶液与0.10mol•L-1NaOH溶液以3:2体积比混合,PH约等于1.699;
(2)0.10mol•L-1HAc溶液与0.10mol•L-1NaOH溶液以3:2体积比混合,混合后为等浓度的乙酸、乙酸钠溶液,溶液中c(H+)<0.02mol/L,
则混合溶液pH>-lg0.02>2-lg2≈1.699,
答:0.10mol•L-1HAc溶液与0.10mol•L-1NaOH溶液以3:2体积比混合,溶液PH略大于1.699;
(3)0.10mol•L-1HCl溶液与0.10mol•L-1NH3溶液以2:3体积比混合,混合后为等浓度的氯化铵、氨水溶液,溶液中c(OH-)<0.02mol/L,混合溶液中c(H+)>$\frac{1{0}^{-14}}{0.02}$=5×10
-13,PH<13-lg5=12.3010,
答:0.10mol•L-1HCl溶液与0.10mol•L-1NH3溶液以2:3体积比混合,溶液PH略小于12.3010;
(4)0.10mol•L-1NaH2PO4溶液与0.10mol•L-1NaOH溶液以2:3体积比混合,混合后为等浓度的磷酸钠、氢氧化钠溶液,溶液中c(OH-)>0.02mol/L,混合溶液中c(H+)<$\frac{1{0}^{-14}}{0.02}$=5×10-13,PH>13-lg5=12.3010,
答:0.10mol•L-1NaH2PO4溶液与0.10mol•L-1NaOH溶液以2:3体积比混合,溶液PH略大于12.3010.
点评 本题考查了pH的计算,先计算溶液中氢离子浓度,再根据pH公式计算溶液的pH值,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2LCO和CO2混合气体中含有碳原子树木为0.5NA | |
| B. | 常温常压下,71g氯气与足量氢氧化钠溶液反应转移的电子数为NA | |
| C. | 92gNO2和N2O4的混合气体中含有的原子总数为6NA | |
| D. | 标准状况下,22.4LCl2完全溶于水中,溶液中n(Cl-)+n(ClO-)+n(HClO)<2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当a≥b时,发生的离子反应为SO32-+Cl2+H2O=SO42-+2H++2Cl- | |
| B. | 当5a=4b时,发生的离子反应为SO32-+2I-+5Cl2+4H2O=4SO42-+I2+8H++10Cl- | |
| C. | 当a≤b≤$\frac{3}{2}$a时,反应中转移电子的物质的量n(e-)为amol≤n(e-)≤3amol | |
| D. | 当a<b<$\frac{3}{2}$a时,溶液中SO42-、I-与Cl-的物质的量之比为a:(3a-2b):2b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
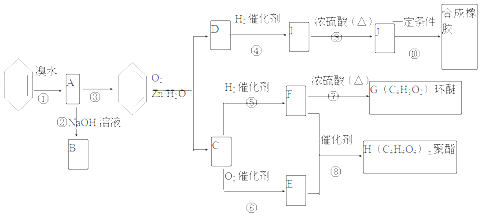
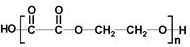
 +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$ +2NaBr.C与足量银氨溶液反应的化学方程式OHC-CHO+4[Ag(NH3)2]OH
+2NaBr.C与足量银氨溶液反应的化学方程式OHC-CHO+4[Ag(NH3)2]OH H4NOOCCOONH4+4Ag↓+6NH3+2H2O
H4NOOCCOONH4+4Ag↓+6NH3+2H2O查看答案和解析>>
科目:高中化学 来源: 题型:实验题
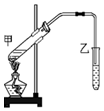 某学习小组为探究乙醇与乙酸的酯化反应,在试管甲中加入3ml乙醇,然后边振荡试管边慢慢加入2ml浓硫酸和2ml乙酸;按如图连接好装置,用酒精灯缓慢加热,将产生的蒸气经导管通到乙试管内的液面上.按要求填空:
某学习小组为探究乙醇与乙酸的酯化反应,在试管甲中加入3ml乙醇,然后边振荡试管边慢慢加入2ml浓硫酸和2ml乙酸;按如图连接好装置,用酒精灯缓慢加热,将产生的蒸气经导管通到乙试管内的液面上.按要求填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油的分馏、裂化和煤的干馏都是化学变化 | |
| B. | 中国民间说的“硝石”是指KNO3,“硝强水”HNO3水溶液 | |
| C. | 乙烯、聚氯乙烯、苯乙烯分子结构中都含有不饱和键 | |
| D. | 分子式为C8H8O2分子结构中含有苯环且能够发生水解反应的同分异构体(不考虑立体异构)有5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com