
【题目】下列表述错误的是( )
A. CS2的结构式为:S=C=S
B. 6CO2+6H2O![]() C6H12O6+6O2,该变化中光能转变为化学能
C6H12O6+6O2,该变化中光能转变为化学能
C. CO2(g)+C(s)![]() 2CO(g)△H>0,△S>0,该反应常温下能自发进行
2CO(g)△H>0,△S>0,该反应常温下能自发进行
D. 可以用酸性高锰酸钾溶液来鉴别乙醇、乙酸和苯
科目:高中化学 来源: 题型:
【题目】某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请回答下列问题:
(1)观察下图(左),标准液盐酸应放入___________滴定管中。(填“甲”或“乙”)
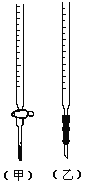
(2)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视__________________________________,滴定终点的现象为_______________。
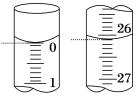
(3)若滴定开始和结束时,酸式滴定管中的液面如上图(右)所示,则起始读数为___________mL,所用盐酸溶液的体积为___________________mL。
(4)某学生根据3次实验分别记录有关数据如表所示:
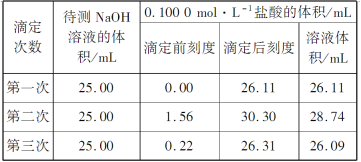
依据表中数据计算该NaOH溶液的物质的量浓度________________。
(5)下列操作中可能使所测NaOH溶液的浓度数值偏低的是_____________(填字母序号)。
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2A2(g)+B2(g) ![]() 2C3(g);△H=-akJ·mol-1(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol·L-1,放出热量b kJ。请回答下列问题:
2C3(g);△H=-akJ·mol-1(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol·L-1,放出热量b kJ。请回答下列问题:
(1)比较a___________b填“>”、“=”、“<”)。
(2)若将反应温度升高到700℃,该反应的平衡常数将_____________(“增大”、“减小”或“不变”)。
(3)能说明该反应已经达到平衡状态的是
A.V(C3)=2V(B2) B.容器内气体压强保持不变
C.V逆(A2)=2V正(B2) D.容器内的气体密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是_____________。
A.及时分离出C3气体 B.适当升高温度
C.增大B2的浓度 D.选择高效的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种非金属元素(除H外),A、B在反应中各结合1个电子,形成稳定结构,与氢气化合产物的稳定性,B>A;原子序数C>D,C、D的稳定结构的核外电子数与A的稳定结构的核外电子数相等,则四种元素的非金属性由强到弱的排列顺序正确的是( )
A.A、B、D、CB.B、A、D、CC.A、B、C、DD.B、A、C、D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求回答下列问题:
(1) O2和O3是氧元素的两种单质。根据分子式回答。
等质量的O2和O3的物质的量之比为________,所含分子数之比为________,原子个数比为____________。
(2) NO2和N2O4是氮元素的两种常见氧化物,常温下都是气体,它们之间在常温下就能相互转化,因而经常见到的是两种气体的混合物。现取46 g该气体,所含氮原子的物质的量为________,所含氧原子个数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硅陶瓷能代替金属制造发动机的耐热部件。工业上用化学气相沉积法制备氮化硅,其反应如下:3SiCl4(g)+2N2(g)+6H2(g)![]() Si3N4(s)+12HCl(g) △H<0。若在恒压绝热容器中反应,下列选项表明反应一定已达化学平衡状态的是( )
Si3N4(s)+12HCl(g) △H<0。若在恒压绝热容器中反应,下列选项表明反应一定已达化学平衡状态的是( )
A. 容器的温度保持不变 B. 容器的压强保持不变
C. υ正(N2)=6υ逆(HCl) D. 容器内的气体c(N2)∶c(H2)∶c(HCl)=1∶3∶6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常压下羰基化法精炼镍的原理为: Ni(s)+4CO(g) ![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断不正确的是
A. 该反应达到平衡时,v分解[Ni(CO)4]=4v消耗(CO)
B. 第一阶段应选择稍高于42.2℃的反应温度
C. 第二阶段,230℃时Ni(CO)4分解率较高
D. 其他条件不变,增加c(CO),平衡向正向移动,反应的平衡常数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
(1)在25℃、101kPa时,8gCH4完全燃烧生成液态水时放出的热量是445.15kJ,则CH4燃烧的热化学方程式_____________。
(2)已知:
C(s)+O2(g) = CO2(g) △H=-437.3kJ·mol -1
H2(g)+1/2O2(g) = H2O(g) △H=-285.8kJ·mol-1
CO(g)+1/2O2(g) = CO2(g) △H=-283.0kJ·mol-1
则煤气化反应C(s)+H2O(g) = CO(g)+H2(g)的焓变△H=___ kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气和水,放出热量624kJ(25℃时),则N2H4完全燃烧反应的热化学方程式是___________________________________________________。
(2)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是30%的KOH溶液。肼—空气燃料电池放电时:正极的电极反应式是______________________________。负极的电极反应式是_____________________________。
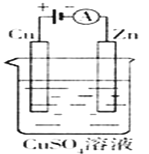
(3)下图是一个电化学过程示意图。
①锌片上发生的电极反应是___________________。
②假设使用肼—空气燃料电池作为本过程中的电源,铜片的质量变化128g,则肼一空气燃料电池理论上消耗标标准状况下的空气__________L(假设空气中氧气体积含量为20%)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com