
【题目】一种从电镍含钴废渣(主要成分有Co(OH)3、Ni(OH)3、Fe(OH)3及少量Ca(OH)2、Mg(OH)2等杂质)中提取氧化钴(Co2O3)的工艺流程如下:
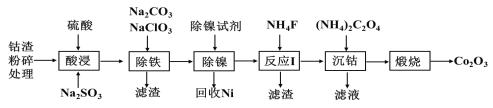
已知:Ksp(CaF2)=3.45×10-11,Ksp(MgF2)=7.42×10-11,Ksp[Co(OH)3]=2×10-44。
(1)在还原剂Na2SO3存在的条件下,钴渣易溶于酸中,请写出酸浸时Co(OH)3与Na2SO3反应的离子方程式______,该步操作中硫酸不宜过量太多的主要原因是 ____。
(2)除铁操作中Fe3+以黄钠铁矾Na2Fe6(SO4)4(OH)12形式从溶液中沉淀析出。中学检验Fe3+的溶液中混有Fe2+的常用试剂是________。
(3)反应Ⅰ中加入NH4F的目的______。
(4)沉钴操作发生的反应为(NH4)2C2O4+CoCl2![]() CoC2O4↓+2NH4Cl,也可用Na2C2O4代替(NH4)2C2O4,若要得到较为纯净的CoC2O4,则合理的加料方式是______(填字母)。
CoC2O4↓+2NH4Cl,也可用Na2C2O4代替(NH4)2C2O4,若要得到较为纯净的CoC2O4,则合理的加料方式是______(填字母)。
a.将Na2C2O4溶液与反应Ⅰ滤液同时加入到反应容器中
b.将Na2C2O4溶液缓慢加入到盛有反应Ⅰ滤液的反应容器中
c.将反应Ⅰ滤液缓慢加入到盛有Na2C2O4溶液的反应容器中
(5)450℃在空气中煅烧发生的化学反应方程式______________________。
【答案】2Co(OH)3+4H++SO32-=2Co2++SO42-+5H2O 下一步操作中会消耗更多的Na2CO3 酸性KMnO4溶液 除去Ca2+和Mg2+ b 3O2+4CoC2O4![]() 2Co2O3+8CO2
2Co2O3+8CO2
【解析】
(1)Na2SO3具有还原性,在酸性条件下,Co(OH)3与Na2SO3反应生成硫酸钴、硫酸钠和水,据此写出离子方程式为;硫酸不宜过量太多,会对后续实验的产生影响,浪费试剂;
(2)Fe2+具有还原性,与酸性KMnO4溶液反应,溶液褪色;
(3)根据流程并结合信息可知,镁离子、钙离子均未除去,以此推测加入NH4F的作用;
(4)Ksp[Co(OH)3]=2×10-44很小,Na2C2O4溶液显碱性,制备CoC2O4时,为防止生成Co(OH)3沉淀,据此进行分析;
(5)CoC2O4在空气中煅烧,生成Co2O3和CO2,据此写出方程式。
(1)Na2SO3具有还原性,在酸性条件下,Co(OH)3与Na2SO3反应生成硫酸钴、硫酸钠和水,离子方程式为:2Co(OH)3+4H++SO32-=2Co2++SO42-+5H2O;因为该流程中,后续实验还需要加入Na2CO3来调节溶液的pH,因此该步操作中硫酸不宜过量太多,否则会消耗更多的Na2CO3;
故答案是:2Co(OH)3+4H++SO32-=2Co2++SO42-+5H2O;下一步操作中会消耗更多的Na2CO3;
(2)Fe2+具有还原性,铁离子具有氧化性,因此可向Fe3+、Fe2+的混合溶液中滴加酸性KMnO4溶液,如果溶液褪色,证明Fe2+的存在;
故答案是:酸性KMnO4溶液;
(3)根据信息可知,氟化钙、氟化镁的溶度积较小,加入NH4F,可以除去溶液中的钙离子和镁离子;
故答案是:除去Ca2+和Mg2+;
(4)Ksp[Co(OH)3]=2×10-44很小,Na2C2O4溶液显碱性,制备CoC2O4时,为防止生成Co(OH))3沉淀,加料时,将Na2C2O4溶液缓慢加入到盛有反应Ⅰ滤液的反应容器中;
故答案选b。
(5)CoC2O4在空气中煅烧,生成Co2O3和CO2,方程式为:3O2+4CoC2O4![]() 2Co2O3+8CO2;
2Co2O3+8CO2;
故答案是:3O2+4CoC2O4![]() 2Co2O3+8CO2。
2Co2O3+8CO2。


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)表中元素原子半径最大的是(写元素符号)___,Y原子的电子排布式是__,Z原子核外电子能量最高的电子亚层是___。
(2)下列事实能说明Y元素的非金属性比S元素强的是___;
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1mol Y单质比1mol S得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(3)CCl4是一种常见的有机溶剂,写出其电子式___,判断其属于含有___(填“极性”、“非极性”)共价键的____分子(填“极性”或“非极性”)。SiH4的沸点比CH4高,原因是___。
(4)碳酸钠溶液中滴入酚酞,溶液显红色,请用离子方程式说明产生该现象的原因:___,在上述红色的溶液中加入少许氯化钙固体,溶液颜色变浅,请用平衡理论解释产生该现象的原因____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1mol CH4和适量的氧气在密闭容器中点燃,充分反应后,甲烷和氧气均无剩余,且产物均为气体 (101 kPa,120℃),其总质量为72g,下列有关叙述不正确的是
A. 若将产物通过碱石灰,则不能全部被吸收,若通过浓琉酸,则不能全部被吸收
B. 产物的平均摩尔质量为42g/mol
C. 若将产物通过浓硫酸充分吸收后恢复至101kPa,120℃,则压强变为原来的1/3
D. 反应中消耗氧气为56g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下0.1molL﹣1醋酸溶液的pH=a,下列能使溶液pH=(a+1)的措施是
A. 将溶液稀释到原体积的2倍B. 加入适量的醋酸钠固体
C. 加入等体积0.2 molL﹣1盐酸D. 加少量冰醋酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各溶液中,离子的物质的量浓度关系正确的是
A.pH=4的醋酸中:c(H+)= 0.4mol·L-1
B.饱和碳酸氢钠溶液中(已知碳酸氢钠溶液呈碱性):c(Na+)= c(HCO3-)
C.饱和食盐水中:c(Na+)+ c(H+)= c(Cl-)+c(OH-)
D.pH=12的纯碱溶液中:c(OH-)=1.0×10-12mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应 2KMnO4 + 16HCl =2KCl + 2MnCl2 + 5Cl2↑ + 8H2O 可用于实验室制取氯气,
(1)该反应中______是氧化剂,_____是氧化产物,_____元素被还原,
(2)浓盐酸在反应中显示出来的性质是________(填序号)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)①用双线桥或单线桥标出下列反应的电子转移方向和数目2KMnO4 + 16HCl = 2KCl + 2MnCl2+ 5Cl2↑+ 8H2O_____________________
②在标准状况下,该反应产生2.24 L Cl2时,消耗氧化剂_____mol,被氧化的物质的质量为_____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将11.5 g钠投入到89 g水中(足量),充分反应后所得溶液的密度为1.25 g·cm-3。
计算:(1)生成H2的体积(标准状况下) _______ 。
(2)所得溶液中溶质的物质的量浓度为多少________ ?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下向20 mL浓度均为0.1 mol·L-1 NH4HSO4 、(NH4)2SO4混合溶液中逐滴加入0.1mol·L-1的Ba(OH)2溶液。充分反应后静置,Ba(OH)2溶液体积与溶液的pH的关系如下图,下列说法正确的是(假设过程中生成的NH3·H2O不分解)
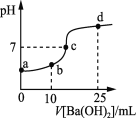
A.a点溶液中:c(NH4+)+c(NH3·H2O)=0.4 mol·L-1
B.b点溶液中:c(NH4+)>c(SO42-)>c(H+)>c(NH3·H2O)>c(OH-)
C.c点溶液中:c(Ba2+) + c(NH4+)=c(SO42-)
D.d点溶液中:c(NH3·H2O)>c(SO42-)>c(NH4+)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列转化关系图,且知采用电解熔融氯化钠的方法可以生产金属钠:2NaCl(熔融)![]() 2Na+Cl2↑,下列说法不正确的是( )
2Na+Cl2↑,下列说法不正确的是( )

A.A、C、E一定含有同种元素B.若在B中点燃铜丝会产生棕黄色烟
C.C与D反应会产生红褐色沉淀D.D物质可能为FeCl2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com