
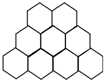
 石墨晶体是层状结构,在每一层内,每个碳原子都跟其他3个碳原子相结合.据图分析,石墨晶体中碳原子数与共价键数之比为( )
石墨晶体是层状结构,在每一层内,每个碳原子都跟其他3个碳原子相结合.据图分析,石墨晶体中碳原子数与共价键数之比为( )| A. | 3:2 | B. | 2:1 | C. | 1:3 | D. | 2:3 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
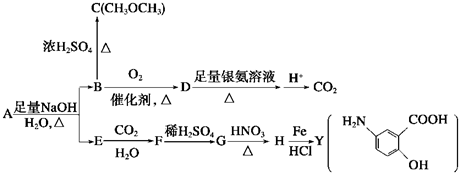
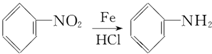
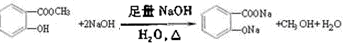 .
.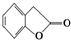 和
和 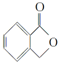 ,鉴别I和J的试剂为FeCl3或浓溴水.
,鉴别I和J的试剂为FeCl3或浓溴水.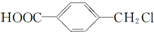 制得,写出K在浓硫酸作用下生成的聚合物的结构简式:
制得,写出K在浓硫酸作用下生成的聚合物的结构简式: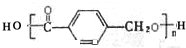 .
.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
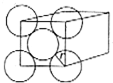 金晶体是面心立方最密堆积,立方体的每个面上5个金原子紧密堆砌(如图,其余各面省略),金原子半径为A cm,求:
金晶体是面心立方最密堆积,立方体的每个面上5个金原子紧密堆砌(如图,其余各面省略),金原子半径为A cm,求:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 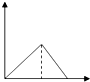 | B. | 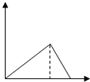 | C. | 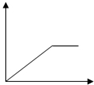 | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com