
 C(气)+D(气),以下能说明已达平衡状态的是
C(气)+D(气),以下能说明已达平衡状态的是 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源:不详 题型:单选题
| A.KW随溶液温度、浓度的改变而改变 |
| B.凡是氧化还原反应,都是放热反应 |
| C.对已达到化学平衡的反应,改变压强,平衡一定改变 |
| D.弱电解质的电离程度,与温度、浓度均有关系 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


| A.反应进行到3min时达到化学平衡状态 |
| B.是否使用催化剂对反应前后的能量变化没有影响 |
| C.当反应物消耗量一定时,若反应生成液态甲醇,能量变化值会更大 |
| D.平衡时氢气的浓度为1mol/L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO2(g)+C(s),T=980 K时,ΔH-TΔS=0,当体系温度低于980 K时,估计ΔH-TΔS应__________0(填“大于”“小于”或“等于”),该反应________________进行;当体系温度高于980 K时,ΔH-TΔS应________________0。在冶金工业中,以碳作还原剂,温度高于980 K时的氧化产物以________________为主,低于980 K时以________________为主。
CO2(g)+C(s),T=980 K时,ΔH-TΔS=0,当体系温度低于980 K时,估计ΔH-TΔS应__________0(填“大于”“小于”或“等于”),该反应________________进行;当体系温度高于980 K时,ΔH-TΔS应________________0。在冶金工业中,以碳作还原剂,温度高于980 K时的氧化产物以________________为主,低于980 K时以________________为主。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.化学反应速率:乙>甲 | B.平衡后N2的浓度:乙>甲 |
| C.H2的转化率:乙>甲 | D.平衡混合气中H2的体积分数:乙>甲 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加热 | B.不用稀硫酸,改用质量分数为98%的浓硫酸 |
| C.不用铁片,改用镁条 | D.不用铁片,改用铁粉 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.化学反应速率理论是研究怎样在一定时间内快出产品 |
| B.化学平衡理论是研究怎样使用有限原料多出产品 |
| C.化学反应速率理论是研究怎样提高原料转化率 |
| D.化学平衡理论是研究怎样使原料尽可能多地转化为产品 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
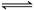 Z(g),达到平衡后生成a mol Z,下列说法错误的是
Z(g),达到平衡后生成a mol Z,下列说法错误的是| A.达到平衡时-v正(Y)=-v逆(Z) |
| B.若向平衡混合物中充入氦气,平衡向左移动 |
| C.若最初向容器中通入的是3molX和3molY,达平衡后Z的物质的量分数为 |
| D.若最初向容器中通入的是3molX、2molY、1molZ,达平衡后容器中n(Z)<3amol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com