
| A. | 氮气在常温下是气体,而磷单质是固体 | |
| B. | N2在空气中不能燃烧,而磷能在空气中燃烧 | |
| C. | NH3极易溶于水,而PH3难溶于水 | |
| D. | 硝酸比磷酸酸性强 |
分析 非金属性强弱的比较方法:①单质与氢气化合的难易程度;②生成的氢化物稳定性;③最高价氧化物的水化物(含氧酸)酸性强弱;④相互置换反应(强制弱);⑤单质得电子的能力比较非金属性强弱等,以此来解答.
解答 解:A.氮气在常温下是气体,而磷单质是固体,物质的状态属于物理性质,与非金属性无关,故A错误;
B.N2在空气中不能燃烧,而磷能在空气中燃烧,是因为氮气中N≡N键比P-P键稳定,与非金属性强弱无关,故B错误;
C.溶解性属于物质的物理性质,与非金属性无关,故C错误;
D.HNO3的酸性比H3PO4强,且二者都是最高价含氧酸,可说明氮的非金属性比磷强,故D正确;
故选D.
点评 本题考查非金属性的比较,把握非金属性强得电子能力强为解答本题的关键,注意归纳非金属性比较的方法即可解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
| 实验操作 | 现象 | 结论 | |
| A | 向某溶液中滴入几滴酸性KMnO4溶液,然后滴加KSCN溶液 | 溶液最终变为红色 | 原溶液中含有Fe3+ |
| B | 向浓度均为0.1mol•L-1NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | KSP(AgCl)>KSP(AgI) |
| C | 用洁净的铂丝蘸取某溶液,在酒精灯火焰上灼烧 | 透过蓝色钴玻璃观察到火焰颜色为紫色 | 原溶液中一定只含K+ |
| D | 在试管中取少量淀粉,加入稀硫酸后加热片刻,冷却后取澄清液滴入新制的Cu(OH)2加热煮沸 | 未见红色沉淀生成 | 淀粉未发生水解 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 78g过氧化钠晶体中,含2NA个阴离子 | |
| B. | 常温常压下,22.4L氦气含有NA个氦原子 | |
| C. | 在H2O2参与的反应中,1 mol H2O2得到或失去的电子数一定是2NA | |
| D. | 常温下16g O2与O3的混合气体中含氧原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{A}{a}$(N-a) mol | B. | $\frac{a}{A+n}$(n+A)mol | C. | $\frac{A}{a+n}$(N+n) mol | D. | $\frac{a}{A+n}$(A-N+n) mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18gD2O中含有的质子数目为10NA | |
| B. | 12.0 g熔融的NaHSO4中含有0.1NA个Na+、0.1NA个H+和0.1NA个SO42- | |
| C. | 氢氧燃料电池工作时,若负极反应0.5g H2时,则正极反应的O2的体积(折算为标况)是2.8L | |
| D. | 22.4LNH3分子中含有的共价键数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第一电离能介于B、N之间的第二周期元素有1种 | |
| B. | 基态Fe原子的外围电子排布图为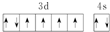 | |
| C. | 因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大 | |
| D. | 根据原子核外电子排布的特点,Cu在元素周期表中位于s区 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
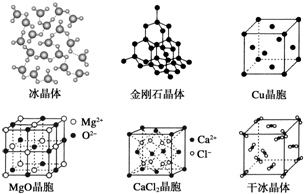
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热CS2CO3可生成CS2O和CO2(CS:铯 IA) | |
| B. | 铊(Tl)与铝同族,其单质既能与HCl又能与NaOH溶液反应 | |
| C. | AgAt为白色沉淀,不溶于稀HNO3(At:砹 VⅡA) | |
| D. | Ra(OH)2是易溶于水的强碱(Ra:镭ⅡA) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com