
(1) 由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式: _ 。
若1g水蒸气转化成液态水放热2.444kJ,则氢气的燃烧热为_____________。
(2)已知① CO(g) + 1/2 O2(g) = CO2(g) ; ΔH1= -283.0 kJ/mol
② H2(g) + 1/2 O2(g) = H2O(l) ; ΔH2= -285.8 kJ/mol
③C2H5OH(l) + 3 O2(g) = 2 CO2(g) + 3H2O(l); ΔH3=-1370 kJ/mol
试写出一氧化碳与氢气反应生成液态水和乙醇液体的热化学方程式:
___________________________________________________________。
(3)Fe(s)+CO2(g) FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K,测得在不同
FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K,测得在不同
温度下,K值如下:
温度/℃ | 500 | 700 | 900 |
K | 1.00 | 1.47 | 2.40 |
①若500℃时进行反应,CO2起始浓度为2 mol·L-1,CO的平衡浓度为________。
②此反应焓变中的a________0(填大于、小于、等于)。
(1)H2(g)+1/2O2(g)═H2O(g)△H=-241.8kJ/mol;285.8kJ/mol
(2)2CO(g)+4H2(g)═H2O(l)+C2H5OH(l);△H=-339.2 kJ/mol
(3)1mol / L; 大于
【解析】
试题分析:(1)氢气和氧气反应生成1mol水蒸气放热241.8kJ,则该反应的热化学方程式为:H2(g)+1/2O2(g)═H2O(g)△H=-241.8kJ/mol;1g水蒸气转化成液态水放热2.444kJ,故18g水蒸气转化成液态水放出热量2.444kJ×18=44kJ,故反应H2(g)+1/2O2(g)═H2O(l)的反应热△H=-(241.8kJ/mol+44kJ/mol)=-285.8kJ/mol,所以氢气的燃烧热为285.8kJ?mol?1。
(2)已知:①CO(g)+1/2O2(g)=CO2(g)△H1=-283.0kJ/mol
②H2(g)+1/2O2(g)=H2O(l)△H.2=-285.8kJ/mol
③C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H3=-1370kJ/mol
根据盖斯定律,①×2-③+②×4得2CO(g)+4H2(g)=H2O(l)+C2H5OH(l)△H.=2△H1-△H3+4△H2=2×(-283.0kJ/mol)-(-1370kJ/mol)+4×(-285.8kJ/mol)=-339.2kJ/mol,所以一氧化碳与氢气反应生成液态水和乙醇液体的热化学方程式为:2CO(g)+4H2(g)═H2O(l)+C2H5OH(l);△H=-339.2 kJ?mol?1。
(3)①令平衡时CO的浓度为cmol/L,则:
Fe(s)+CO2(g)═FeO(s)+CO(g)
开始(mol/L): 2 0
变化(mol/L): c c
平衡(mol/L): 2-c c
则c÷(2mol?L?1—c)=1,解得c=1mol?L?1。
②由表中数据可知,对于反应①,温度越高平衡常数越大,说明升高温度平衡向正反应移动,升高温度平衡向吸热反应进行,故a>0,所以答案为:大于。
考点:本题考查热化学方程式的书写、燃烧热、化学平衡的计算、化学平衡移动。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014-2015学年甘肃甘谷县第一中学高一上学期第一次月考化学试卷(解析版) 题型:填空题
(每空2分,共14分)(1)483g Na2SO4·10H2O中所含的Na+的物质的量是 和SO42—的物质的量是 ,所含H2O分子的数目是 个。
(2)同温同压下,同体积的氨气(NH3)和氧气的质量比是__________,相同质量的氨气和氧气的体积比是________;
(3)同温同压下同体积的H2和A气体的质量分别是0.2 g和1.6 g,则气体A的相对分子质量为________,含有A的分子个数为________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃天水市高二上第一阶段考试卷化学试卷(解析版) 题型:选择题
某温度下,反应2N2O5 4NO2+O2开始进行时,c(N2O5)=0.040 8 mol/L。经1 min后,c(N2O5)=0.030 mol/L。则该反应的反应速率为( )
4NO2+O2开始进行时,c(N2O5)=0.040 8 mol/L。经1 min后,c(N2O5)=0.030 mol/L。则该反应的反应速率为( )
A.v(N2O5)=1.8×10-4 mol/(L·s) B.v(N2O5)=1.08×10-2 mol/(L·s)
C.v(NO2)=1.8×10-4 mol/(L·s) D.v(O2)=1.8×10-4 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南长沙市高三上学期第二次月考化学试卷(解析版) 题型:选择题
A、B、C、X均为中学化学常见的物质,它们之间有如下转化关系(其它产物已略去):
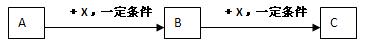
下列说法不正确的是
A.若A是NH3则C可能是氧化物
B.若A是非金属单质,则C与水反应的生成物为强酸
C.若X是金属单质,则B、C 中X的化合价可能是B>C
D.若X是强碱,则B可能是两性物质
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南长沙市高三上学期第二次月考化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.向含有CaCO3沉淀的水中通入CO2至沉淀恰好溶解,再向溶液中加入NaHCO3饱和溶液,又有CaCO3沉淀生成
B.向Na2 CO3溶液中逐滴加入含等物质的量HCl的稀盐酸,生成的CO2与原Na2 CO3的物质的量之比为1:2
C.等质量的Na HCO3和Na2 CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积相同
D.向Na2 CO3饱和溶液中通入CO2,有Na HCO3结晶析出
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南邵阳县石齐学校高二上第一次月考化学(理)试卷(解析版) 题型:选择题
在容积不变的密闭容器中,在一定条件下发生反应:2A(?) B (g)+C(s),且达到平衡,当升高温度时,容器内气体的密度变大,则下列判断错误的是
B (g)+C(s),且达到平衡,当升高温度时,容器内气体的密度变大,则下列判断错误的是
A.若正反应为吸热反应,则A为非气态
B.若正反应为放热反应,则A为气态
C.若在平衡体系中加入少量C,则该平衡不移动
D.压强对该平衡的移动无影响
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南邵阳县石齐学校高二上第一次月考化学(理)试卷(解析版) 题型:选择题
下列事实不能用勒沙特列原理解释的是( )
A.由H2、I2蒸气、HI组成的平衡体系加压后颜色变深
B.增大压强,有利于SO2和O2反应生成SO3
C.用排饱和食盐水法收集Cl2
D.工业制取金属钾Na(l)+ KCl(l)  NaCl(l)+ K(g)选适宜的温度,使K成蒸气从反应混合物中分离出来
NaCl(l)+ K(g)选适宜的温度,使K成蒸气从反应混合物中分离出来
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省衡阳市高二上学期期中考试化学试卷(解析版) 题型:填空题
(8分)在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) 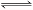 CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
T/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应为________反应(填“吸热”“放热”).
(2)能判断该反应是否已达化学平衡状态的依据是________.
a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(3)某温度下,在2 L的密闭容器中,加入1 mol CO2和1 mol H2充分反应达平衡时,CO平衡浓度为0.25 mol/L,试判断此时的温度为________℃.
(4)若在(3)所处的温度下,在1 L的密闭容器中,加入2 mol CO2和3 mol H2充分反应达平衡时,H2的物质的量为________.
a.等于1.0 mol
b.大于1.0 mol
c.大于0.5 mol,小于1.0 mol
d.无法确定
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省高三上学期第二次月考化学试卷(解析版) 题型:选择题
用自来水配制下列溶液,不会变质的是( )
A.AgNO3 B.Na2CO3 C.NaCl D.KI
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com