
 .若H分子中所有碳原子均在一条直线上,则G转化为H的化学方程式为CH3CHBrCHBrCH3+2NaOH$→_{△}^{醇}$H3CC≡CCH3↑+2NaBr+2H2O.
.若H分子中所有碳原子均在一条直线上,则G转化为H的化学方程式为CH3CHBrCHBrCH3+2NaOH$→_{△}^{醇}$H3CC≡CCH3↑+2NaBr+2H2O. .
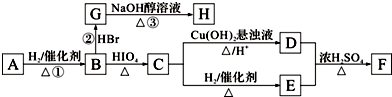
.分析 由于A分子中C、H、O三种元素的质量比为6:1:4可知C、H、O的物质的量之比为2:4:1;又由于A的质谱图中质荷比最大值为88,所以A的分子式为C4H8O2,根据分子式可知A中有一个不饱和度,又不能使Br2的CCl4溶液褪色,所以A中存在C=O键,再根据1mol B反应生成了2mol C,结合已知条件可推知A的结构为:CH3COCH(OH)CH3,这样可以进一步推出B、C、D、E、F的结构简式,它们依次是:CH3CH(OH)CH(OH)CH3、CH3CHO、CH3COOH、CH3CH2OH、CH3COOCH2CH3,由于B与HBr发生取代反应生成卤代物,再在NaOH醇溶液中发生消去反应,且H分子中所有碳原子均在一条直线上,所以可以推得G和H的结构分别为:CH3CHBrCHBrCH3、H3CC≡CCH3,据此分析解答.
解答 解:由于A分子中C、H、O三种元素的质量比为6:1:4可知C、H、O的物质的量之比为2:4:1;又由于A的质谱图中质荷比最大值为88,所以A的分子式为C4H8O2,根据分子式可知A中有一个不饱和度,又不能使Br2的CCl4溶液褪色,所以A中存在C=O键,再根据1mol B反应生成了2mol C,结合已知条件可推知A的结构为:CH3COCH(OH)CH3,这样可以进一步推出B、C、D、E、F的结构简式,它们依次是:CH3CH(OH)CH(OH)CH3、CH3CHO、CH3COOH、CH3CH2OH、CH3COOCH2CH3,由于B与HBr发生取代反应生成卤代物,再在NaOH醇溶液中发生消去反应,且H分子中所有碳原子均在一条直线上,所以可以推得G和H的结构分别为:CH3CHBrCHBrCH3、H3CC≡CCH3,
(1)由上面的分析可知,A为CH3COCH(OH)CH3,故答案为:CH3COCH(OH)CH3;
(2)由A合成H的总产率应为①,②、③三步反应的产率之积,所以由A合成H的总产率=90.0%×82.0%×75.0%=55.4%,
故答案为:55.4%;
(3)D+E→F反应为乙酸与乙醇反应生成乙酸乙酯,反应类型为酯化反应,故答案为:酯化反应;
(4)由上面的分析可知,C为乙醛,它与银氨溶液反应的离子方程式为:CH3CHO+2[Ag(NH3)2]++2OH- $\stackrel{△}{→}$CH3COO-+NH4++2Ag↓+3NH3+H2O,
故答案为:CH3CHO+2[Ag(NH3)2]++2OH- $\stackrel{△}{→}$CH3COO-+NH4++2Ag↓+3NH3+H2O;
(5)若H分子中所有碳原子不在一条直线上,则H为1,3-丁二烯,H在一定条件下合成顺丁橡胶的化学方程式为 ,由于B是2,3-丁二醇,与HBr发生取代反应生成卤代物
,由于B是2,3-丁二醇,与HBr发生取代反应生成卤代物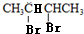 ,再在NaOH醇溶液中发生消去反应生成H,且H分子中所有碳原子均在一条直线上,所以可以推得G和H的结构,G为
,再在NaOH醇溶液中发生消去反应生成H,且H分子中所有碳原子均在一条直线上,所以可以推得G和H的结构,G为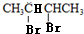 H为
H为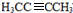 ,G转化为H的化学方程式为CH3CHBrCHBrCH3+2NaOH$→_{△}^{醇}$H3CC≡CCH3↑+2NaBr+2H2O,
,G转化为H的化学方程式为CH3CHBrCHBrCH3+2NaOH$→_{△}^{醇}$H3CC≡CCH3↑+2NaBr+2H2O,
故答案为: ;CH3CHBrCHBrCH3+2NaOH$→_{△}^{醇}$H3CC≡CCH3↑+2NaBr+2H2O;
;CH3CHBrCHBrCH3+2NaOH$→_{△}^{醇}$H3CC≡CCH3↑+2NaBr+2H2O;
(6)A的结构为: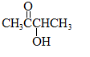 ,根据条件:
,根据条件:
a.X核磁共振氢谱有3个峰,峰面积之比为1:1:2,即X有三种位置的氢,且个数之比为1:1:2,
b.1mol X可在HIO4加热的条件下反应,可形成1mol 二元醛,根据信息可知X应为含有两个羟基的环状物,
c.1mol X最多能与2mol Na反应,说明X有2个羟基,d.X不与NaHCO3反应,也不与NaOH反应,也不与Br2发生加成反应,说明有X没有羧基,不含有碳碳双键,则X的结构为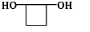 ,
,
故答案为: .
.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断能力及知识迁移能力,根据反应条件、题给信息采用正向思维进行推断,难点是同分异构体结构简式判断,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
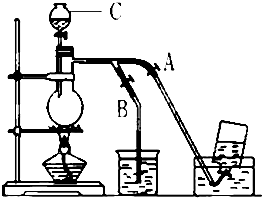 如图表示在没有通风橱的条件下制备氯气时设计的装置,图中a、b是可控制的弹簧铁夹.(氯气在饱和氯化钠溶液中的溶解度较小.)
如图表示在没有通风橱的条件下制备氯气时设计的装置,图中a、b是可控制的弹簧铁夹.(氯气在饱和氯化钠溶液中的溶解度较小.)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 装置 |  CuSO4溶液 | 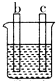 稀硫酸 | 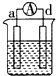 稀硫酸 |
| 现象 | a极质量减小 b极质量增大 | b极有气泡 c极无明显现象 | 电流从a极流向d极 |
| A. | d>a>b>c | B. | b>c>d>a | C. | a>b>c>d | D. | a>b>d>c |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
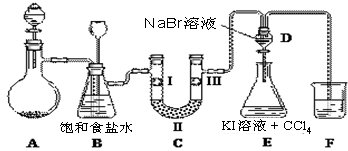
| 选项 | Ⅰ | Ⅱ | Ⅲ |
| A | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| B | 干燥的有色布条 | 硅胶 | 湿润的有色布条 |
| C | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| D | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q1=Q2=Q3 | B. | Q2>Q1>Q3 | C. | Q2>Q3>Q1 | D. | Q2=Q3>Q1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合金中至少含有两种金属 | |
| B. | 漂白粉能在空气中长期存放 | |
| C. | 工艺师利用氢氟酸刻蚀石英制作艺术品 | |
| D. | NaOH溶液保存在配有磨口玻璃塞的细口试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向0.1mol-1•LNa2CO3溶液中通入适量CO2气体后:c(Na+)=2[c(HCO3-)+c(CO32-)+c(H${\;}_{{2}_{\;}}$CO3)] | |
| B. | 在pH=8的NaB溶液中:c(Na+)-c(B-)=9.9×10-7mol•L-1 | |
| C. | 在0.1mol•L-1NaHSO3溶液中通入少量NH3气体后:c(Na+)+c(H+)=c(HSO-3)+2c(SO32-) | |
| D. | 在0.1mol•L-1的氯化铵溶液中:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com