
| A. | 25℃时,NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7mol•L-1 | |
| B. | 25℃时,向0.1mol•L-1NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+) | |
| C. | 0.1mol•L-1的NaHCO3溶液中:c(OH-)+2c(CO32-)=c(H+)+c(H2CO3) | |
| D. | 同温下,pH相同时,溶液物质的量浓度:c(CH3COONa)>c(NaHCO3)>c(Na2CO3)>c(C6H5ONa) |
分析 A.根据NaB溶液中的电荷守恒分析;
B.溶液呈中性,则c(OH-)=c(H+),根据电荷守恒判断;
C.根据物料守恒及电荷守恒判断;
D.pH相同的不同钠盐溶液,阴离子的水解程度越大,其钠盐的物质的量浓度越小.
解答 解:A.pH=8的溶液中氢离子浓度为:1×10-8mol•L-1,氢氧根离子浓度为:1×10-7mol•L-1,根据电荷守恒得:c(Na+)+c(H+)=c(OH-)+c(B-),则c(Na+)-c(B-)=c(OH-)-c(H+)=9.9×10-7mol•L-1,故A正确;
B.溶液呈中性,则c(OH-)=c(H+),溶液中铵根离子水解,而硫酸根离子、钠离子不水解,结合电荷守恒得c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),故B错误;
C.溶液中存在物料守恒得c(Na+)=c(H2CO3)+c(CO32-)+c(HCO3-)=0.1mol/L,根据电荷守恒得c(Na+)+c(H+)=c(OH-)+2c( CO32-)+c(HCO3-),所以得c(OH-)+c(CO32-)=c(H+)+c(H2CO3),故C错误;
D..pH相同的不同钠盐溶液,阴离子的水解程度越大,其钠盐的物质的量浓度越小,这几种阴离子的水解程度大小顺序是CO32->C6H5O->HCO3->CH3COO-,所以相同温度下,pH相同时,溶液物质的量浓度:c(CH3COONa)>c(NaHCO3)>c(C6H5ONa)>c(Na2CO3),故D错误;
故选A.
点评 本题考查离子浓度大小的比较,题目难度中等,根据电荷守恒和物料守恒来分析解答,易错选项是D,注意pH相同的不同钠盐物质的量浓度的比较方法,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L | B. | 0.2 mol/L | C. | 0.4 mol/L | D. | 0.6mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中,H+、Br-可以大量共存 | |
| B. | 该溶液中,Ag+、K+、CH3CHO可以大量共存 | |
| C. | 向该溶液中滴入少量FeSO4溶液,反应的离子方程式为:2Fe2++ClO-+2H+═Cl-+2Fe3++H2O | |
| D. | 向该溶液中加入浓盐酸,每产生1molCl2,转移电子约为6.02×1023个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
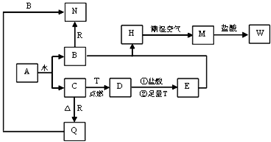 已知A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀,且在潮湿空气中迅速变为灰绿色,最终变为红褐色固体.
已知A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀,且在潮湿空气中迅速变为灰绿色,最终变为红褐色固体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同质量、不同密度的N2和CO | B. | 同温度、同体积的H2和N2 | ||
| C. | 同体积、同密度的C2H6和NO | D. | 同压强、同体积的N2O和CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3=Na++HCO3- | B. | H2SO4?2H++SO42- | ||
| C. | NaHSO3=Na++H++SO32- | D. | 熔融状态下:NaHSO4=Na++H++SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com