
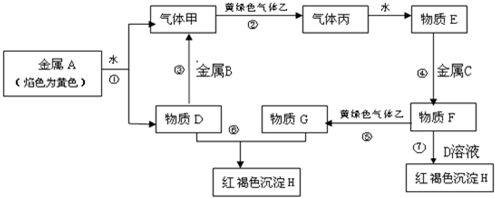
分析 金属A焰色反应为黄色,故A为金属Na,乙是黄绿色气体,乙为Cl2,H为红褐色沉淀,为Fe(OH)3;由反应①Na→气体甲+D,考虑Na与水的反应,故甲为H2,D为NaOH,由NaOH+金属B→H2可知,B为金属Al,由甲+乙→丙,故丙为HCl,HCl溶于水的物质E,故E为盐酸;G+NaOH→Fe(OH)3,G含有Fe3+,由E(盐酸)$\stackrel{金属C}{→}$F$\stackrel{Cl_{2}}{→}$G可知,C为Fe,F为FeCl2,G为FeCl3,FeCl2与氢氧化钠在空气中生成氢氧化铁,符合各物质的转化关系,以此解答该题.
解答 解:金属A焰色反应为黄色,故A为金属Na,乙是黄绿色气体,乙为Cl2,H为红褐色沉淀,为Fe(OH)3;由反应①Na→气体甲+D,考虑Na与水的反应,故甲为H2,D为NaOH,由NaOH+金属B→H2可知,B为金属Al,由甲+乙→丙,故丙为HCl,HCl溶于水的物质E,故E为盐酸;G+NaOH→Fe(OH)3,G含有Fe3+,由E(盐酸)$\stackrel{金属C}{→}$F$\stackrel{Cl_{2}}{→}$G可知,C为Fe,F为FeCl2,G为FeCl3,FeCl2与氢氧化钠在空气中生成氢氧化铁,
(1)由以上分析可知A为Na,F为FeCl2,故答案为:Na;FeCl2;
(2)氯气具有强氧化性,可用于杀菌消毒,也可制备盐酸,故答案为:自来水消毒或制造盐酸;
(3)氯化铁、盐酸溶液的颜色不同,可用氢氧化钠反应,可也用KSCN溶液鉴别,
故答案为:观察两种溶液颜色;硫氰化钾溶液或氢氧化钠溶液;
(4)钠和水反应的离子方程式为2Na+2H2O=2Na++2OH-+H2↑,故答案为:2Na+2H2O=2Na++2OH-+H2↑;
(5)反应⑦为FeCl2与氢氧化钠在空气中生成氢氧化铁,反应的化学方程式为FeCl2+2NaOH=2NaCl+4Fe(OH)2↓、4Fe(OH)2+O2+2H2O=4Fe(OH)3.
故答案为:FeCl2+2NaOH=2NaCl+4Fe(OH)2↓、4Fe(OH)2+O2+2H2O=4Fe(OH)3.
点评 本题考查无机物的推断,为高频考点,把握红褐色沉淀、铝热反应、Fe和Al的化合物性质为解答的关键,侧重分析、推断及应用能力的考查,综合性较强,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 实验室利用石灰石与稀盐酸制取CO2:CO32-+2H+=CO2↑+H2O | |
| B. | 氯气与H2O的反应:Cl2+H2O=2H++Cl-+ClO- | |
| C. | Ba(OH)2溶液与稀H2SO4混合:Ba2++SO42-=BaSO4↓ | |
| D. | 氧化钠与盐酸反应:Na2O+2H+=2Na++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气与水发生反应,氯气在反应中减少1mol,溶液中生成的HClO分子数恰好为NA | |
| B. | 标准状况下,足量的Fe与2.24 L Cl2反应转移电子的数目为0.3NA | |
| C. | 100 mL pH=2的新制氯水中:N(OH-)+2N(ClO-)+N(HClO)=0.001 NA | |
| D. | 1.6 g CH4含有共用电子对的数目为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径逐渐减小 | B. | 元素原子得电子能力逐渐增强 | ||
| C. | 气态氢化物稳定性逐渐增强 | D. | 最高化合价逐渐增高 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
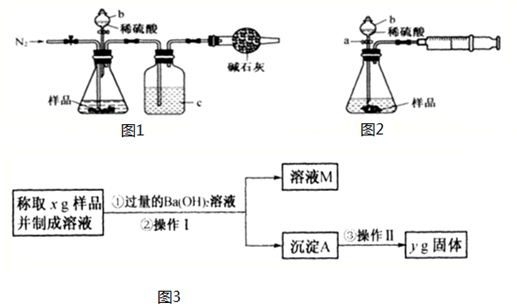
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓H2SO4有氧化性,稀H2SO4无氧化性 | |
| B. | 由于浓H2SO4具有吸水性,故可用来与蔗糖反应做“黑面包”实验 | |
| C. | 稀H2SO4与铁、铝反应,浓H2SO4在常温下不与铁、铝反应 | |
| D. | 浓硫酸与铜片加热反应,既表现了酸性,又表现出强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
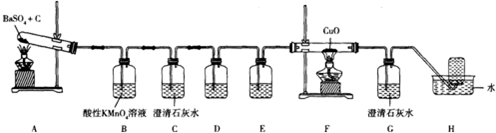
| 方案 | 操作过程及现象 |
| 甲 | 向第l支试管中滴加稀盐酸,将产生的气体通入溴水中,溴水褪色 |
| 乙 | 向第2支试管中滴加稀盐酸,将产生的气体分别通入品红溶液、CuSO4溶液中,品红溶液无变化,CuSO4溶液中产生黑色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com