
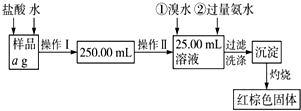
 某氯化铁样品含有少量FeCl2杂质.现要测定其中铁元素的质量分数,实验按以下步骤进行:请根据流程,回答以下问题:
某氯化铁样品含有少量FeCl2杂质.现要测定其中铁元素的质量分数,实验按以下步骤进行:请根据流程,回答以下问题:分析 本实验目的是测定铁的质量分数,采取的方法是使样品溶解、反应、最终生成氧化铁,然后通过氧化铁质量来求铁的质量分数,
(1)根据配制一定物质的量浓度的溶液所需要的仪器有:量筒、胶头滴管、烧杯、玻璃棒、一定规格的容量瓶;根据操作II量取的溶液体积的准确度判断;
(2)根据Br2具有氧化性,能氧化Fe2+;为了使Fe3+充分沉淀,氨水要过量;
(3)根据铁元素质量守恒,即红棕色固体( Fe2O3)中的铁就是样品中铁,根据质量分数的公式求出铁元素的质量分数.
解答 解:实验目的为测定铁的质量分数,采取的方法是使样品溶解、反应、最终生成氧化铁,然后通过氧化铁质量来求铁的质量分数,
(1)因配制一定物质的量浓度的溶液所需要的仪器有:量筒、胶头滴管、烧杯、玻璃棒、一定规格的容量瓶,配制250mL溶液时还缺少250mL容量瓶;因操作II量取25.00mL的溶液,烧杯无法量取,量筒的准确度不够,则需要使用25mL的滴定管,
故答案:250mL容量瓶;D;
(2)因Br2具有氧化性,能氧化Fe2+,反应的离子方程式为:2Fe2++Br2=2Fe3++2Br-;为了使Fe3+充分沉淀,氨水要过量,
故答案为:2Fe2++Br2=2Fe3++2Br-;使Fe3+充分沉淀;
(3)因铁元素质量守恒,即红棕色固体中的铁就是样品中铁,Fe2O3中铁元素的质量为(W2-W1)g×$\frac{112}{160}$,
则样品中铁元素的质量分数为:$\frac{112({W}_{2}-{W}_{1})}{160a}$×100%,
故答案为:$\frac{112({W}_{2}-{W}_{1})}{160a}$×100%.
点评 本题考查了探究物质组成、测量物质含量的方法,题目难度中等,涉及配制一定物质的量浓度的溶液方法、离子方程式书写、质量分数的计算等知识,注意掌握化学实验基本操作方法,试题培养了学生的分析、理解能力及化学实验、化学计算能力.


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 铜是还原剂,发生了氧化反应 | |
| B. | 每生成1 mol SO2,转移电子的物质的量是2 mol | |
| C. | 每消耗 1 mol Cu,起氧化剂作用的硫酸消耗2 mol | |
| D. | 反应后物质中可能有白色固体出现 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
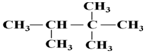 :2,2,3-三甲基丁烷;
:2,2,3-三甲基丁烷;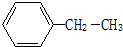 乙苯
乙苯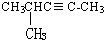 4-甲基-2-戊炔.
4-甲基-2-戊炔.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石的网状结构中,由共价键形成的最小碳环上有6个碳原子 | |
| B. | 在NaCl晶体中每个Na+(或Cl-)周围都紧邻6个Cl-(或6个Na+) | |
| C. | 白磷晶体中,粒子之间通过共价键结合,键角为60° | |
| D. | 离子晶体在熔化时,离子键被破坏;而分子晶体熔化时,化学键不被破坏 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 臭氧层中氟利昂释放出的氯原子是O3分解的催化剂 | |
| B. | 高压放电条件下O2可以转化成O3 | |
| C. | t℃时,3O2(g)?2O3(g),K≈3.33×10-77 | |
| D. | 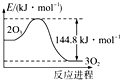 O3转变为O2能量曲线可用图表示 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
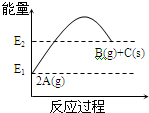
| A. | 1molC(s)的能量高于2molA(g)能量 | |
| B. | 该反应的热化学方程式为:2A(g)═B(g)+C(s)△H=(E1-E2)kJ/mol | |
| C. | 反应过程中当v(A)=0.4mol/(L•s),则v(C)=0.2mol/(L•s) | |
| D. | 该反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀释浓硫酸时,可先在量筒中加入一定体积蒸馏水,再沿量筒内壁慢慢注入浓硫酸,并用玻璃棒不断搅拌 | |
| B. | 过滤时,玻璃棒的末端应轻轻靠在三层滤纸的一边,漏斗里的溶液应低于滤纸的边缘 | |
| C. | 燃着的酒精灯不慎打翻,应立即用水灭火 | |
| D. | 用药匙或纸槽把粉末状药品送入到试管的底部,如果没有试管夹,可以临时手持试管给固体加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Al元素被还原 | |
| B. | Al2O3是氧化产物 | |
| C. | Fe2O3既是氧化剂又是还原剂 | |
| D. | 每生成1molFe时,转移电子的物质的量为3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com