
某待测液中可能含有大量的Mg2+、A13+、Cu2+、K+、H+阳离子中的一种或几种,现通过如下实验进行检验:
(1)取少量待测液,仔细观察,呈无色;
(2)取少量待测液滴加NaOH溶液,立即有白色沉淀生成,NaOH溶液过量后沉淀部分溶解。据此可以判断该待测液中一定大量存在的阳离子是 ,一定不能大量存在的阳离子是 ,不能确定是否存在的阳离子是 ,检验这种离子的实验方法名称是 。
 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
常见化合物A、B,其焰色反应均呈黄色,C是一种单质。转化关系如图所示(其他物质均已略去)。

回答下列问题:
(1)A在通常情况下为淡黄色粉末,常做潜水艇中的供氧剂,写出A的化学式__________。
(2) 写出④的化学方程式______________________________________。
(3) 若溶液E中仅含一种溶质,写出⑤的离子方程式______________________________。
(4) 若A、B混合物在密闭容器中加热,充分反应后,只得到一种固体化合物。则A、B的物质的量之比为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
加热10.0 g碳酸钠和碳酸氢钠的混合物至质量不再变化,剩余固体的质量为8.45 g,求混合物中碳酸钠的质量分数( )
A.42% B.58% C.36% D.64%
查看答案和解析>>
科目:高中化学 来源: 题型:
杨老师在课堂上出示两瓶失去标签的Na2CO3和NaHCO3无色饱和溶液,希望班里同学提出简便的鉴别方法,该班同学踊跃提出看法,其中合理的是( )
A.取同量的溶液于两支试管中,各滴入酚酞试液,红色较深的是Na2CO3
B.取同量的溶液于两支试管中,加热,有气泡产生的是NaHCO3
C.取同量的溶液于两支试管中,逐滴加入稀盐酸,开始就有气体放出的是NaHCO3
D.取同量的溶液于两支试管中,滴加Ba(OH)2溶液,生成白色沉淀的是Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题。
(1)上述实验中发生反应的化学方程式有_______________________________________________。
(2)硫酸铜溶液可以加快氢气生成速率的原因是_________________________________________。
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO 4溶液起相似作用的是________。
4溶液起相似作用的是________。
(4)要加快上述实验中气体产生的速率,还可采取的措施有______________________(答两种)。
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
| 混合溶液 | A | B | C | D | E | F |
| 4 mol·L-1 H2SO4/mL | 30 | V1 | V2 | V3 |
| V5 |
| 饱和CuSO4 溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V1=________,V6=________,V9=________。
②反应一段时间后,实验A中的金属呈________色,实验E中的金属呈________色。
③该同学最后得出的结论为当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,10 mL 0.40 mol/L H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)( )
A.0~6 min的平均反应速率:
v(H2O2)≈3.3×10-2mol·L-1·min-1
B.0~6 min的平均反应速率:
v(H2O2)<3.3×10-2mol·L-1·min-1
C.反应至6 min时,c(H2O2)=0.30 mol/L
D.反应至6 min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
在一密闭容器中发生反应N2+3H2 2NH3,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:
2NH3,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:
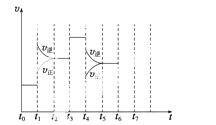
回答下列问题:
(1)处于平衡状态的时间段是________(填选项)。
A.t0~t1 B.t1~t2 C.t2~t3
D.t3~t4 E.t4~t5 F.t5~t6
(2)t1、t3、t4时刻分别改变的一个条件是(填选项)。
A.增大压强 B.减小压强 C.升高温度
D.降低温度 E.加催化剂 F.充入氮气
t1时刻__ ______;t3时刻________;t4时刻________。
______;t3时刻________;t4时刻________。
(3)依据(2)中的结论,下列时间段中,氨的百分含量最高的是__________(填选项)。
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
(4)如果在t6时刻,从反应体系中分离出部分氨,t7时刻反应达到平 衡状态,请在图中画出反应速率的变化曲线。
衡状态,请在图中画出反应速率的变化曲线。
(5)一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数为20%,则反应后与反应前的混合气体体积之比为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
|
| A. | Li在氧气中燃烧主要生成Li2O2 |
|
| B. | 将SO2通入BaCl2溶液可生成BaSO3沉淀 |
|
| C. | 将CO2通入次氯酸钙溶液可生成次氯酸 |
|
| D. | 将NH3通入热的CuSO4溶液中能使Cu2+还原成Cu |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com