
 ( )
( )| A. | 不同温度下的平衡常数K3<K4<K5 | |
| B. | 正反应速率:vB=vD | |
| C. | 当体系气体的平均相对分子质量不再改变时,不能说明反应达到平衡状态 | |
| D. | A、B、D、E点均未达到平衡状态,C点达到平衡状态 |
分析 在容积相同的不同密闭容器内,分别充入等物质的量NH3和HCl,反应相同时间内,达到平衡状态之前,温度越高,反应速率越大,生成NH4Cl的质量增大,达到平衡后,升高温度,NH4Cl的质量减小,说平衡向逆反应方向移动,故该反应是放热反应.在图中转折点C为平衡状态,转折点左侧(A、B)为平衡状态之前,右侧(D、E)为平衡移动到达新的平衡状态.
解答 解:在容积相同的不同密闭容器内,分别充入等物质的量NH3和HCl,反应相同时间内,达到平衡状态之前,温度越高,反应速率越大,生成NH4Cl的质量增大,达到平衡后,升高温度,NH4Cl的质量减小,说平衡向逆反应方向移动,故该反应是放热反应.在图中转折点C为平衡状态,转折点左侧(A、B)为平衡状态之前,右侧(D、E)为平衡移动到达新的平衡状态.
A.升高温度,平衡逆向移动,平衡常数减小,则平衡常数平衡常数K3>K4>K5,故A错误;
B.单位时间内生成氯化铵的质量相等,则正反应速率:vB=vD,故B正确;
C.平衡混合气体中只有氨气与HCl,二者起始物质的量之比为1:1,且按物质的量1:1反应,二者物质的量之比始终为1:1,气体的平均相对分子质量始终不变,故C错误;
D.A、B未到达平衡,C点达到平衡状态,D、E点达到平衡状态,故D错误.
故选:B.
点评 本题考查化学平衡图象、化学反应速率和化学平衡的影响因素,难度中等,关键是判断C点是平衡点.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 molNa2O2和水完全反应,转移电子数为2NA | |
| B. | 0.5 L 0.2 mol•L-1FeCl3溶液中,含Fe3+离子数为0.1 NA | |
| C. | 理论上氢氧燃料电池负极消耗11.2 L标准状况下气体,外线路通过电子数为NA | |
| D. | 常温常压下,28 g乙烯和丙烯混合气体含有的碳原子总数为2.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 操作 | 现象与结论 | 离子方程式 |
| 第一步 | 取少量溶液装于试管,向试管中加入几滴KSCN溶液 | ||
| 第二步 | 若溶液紫色褪去,则溶液含有Fe2+;若无明显变化,则不含Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,1L0.1mol•L-1NaClO溶液中阴离子总数大于0.1NA | |
| B. | 7.8gNa2O2中含有的阴、阳离子总数是0.3NA | |
| C. | N2H2分子中各原子的最外层(除H外)均为8电子结构,1molN2H2中有共用电子对数目为3NA | |
| D. | 50mL18mol•L-1浓硫酸与足量铜反应,转移电子数小于0.9NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+) | B. | c(Na+)+c(H+)═c(S2-)+c(HS-)+c(OH-) | ||
| C. | c(Na+)═c(HS-)+2c(H2S)+2c(S2-) | D. | c(OH-)═c(H+)+c(HS-)+c(H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
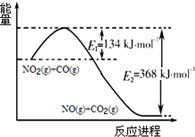 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一.
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一.| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
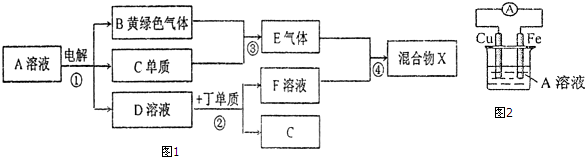
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com