
| A、Z-、B-、A2+、X2+中Z-的还原性最强 |
| B、反应Z2+2A2+=2A3++2Z-可以进行 |
| C、Z元素在反应①中被氧化,反应③中被还原 |
| D、氧化性:XO4->Z2>B2>A3+ |


科目:高中化学 来源: 题型:
| A、分解反应一定是氧化还原反应 |
| B、氧化还原反应的特征:化合价发生变化 |
| C、还原剂就是反应中被还原的物质 |
| D、在氧化还原反应中,失去电子的元素化合价降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、① | B、② | C、②③ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属钠具有强还原性,可用与TiCl4溶液反应制取金属Ti |
B、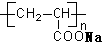 表示一种吸水性高分子树脂 表示一种吸水性高分子树脂 |
| C、用于现代建筑的钢筋混凝土不属于复合材料 |
| D、山东东营广饶县一男子收到网购物品后,因吸入氟乙酸甲酯中毒身亡,氟乙酸甲酯的结构简式为FCH2COOCH3,能与H2发生加成反应,也能被LiAlH4还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Z为0.3mol/L |
| B、Y2为0.35mol/L |
| C、X2为0.2mol/L |
| D、Z为0.15mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
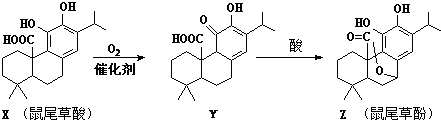
| A、X、Y、Z互为同分异构体 |
| B、1mol X与NaOH溶液反应最多消耗3mol NaOH |
| C、X、Y、Z分子中均含有2个手性碳原子 |
| D、X、Y均能与FeCl3溶液发生显色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硝酸与金属反应时,主要是+5价的氮得电子 |
| B、浓HNO3与所有金属都能反应 |
| C、硝酸溶液中的H+离子,能被Zn、Fe等金属还原成H2 |
| D、常温下,向浓HNO3中投入Fe片,会产生大量的红棕色气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com