
 我国锑的蕴藏量占世界第一位,辉锑矿(Sb2S3)是其主要矿物.某冶金课题组设计的一种提取锑的工艺流程如图.
我国锑的蕴藏量占世界第一位,辉锑矿(Sb2S3)是其主要矿物.某冶金课题组设计的一种提取锑的工艺流程如图.分析 传统工艺在空气中灼烧辉锑矿粉,会生成二氧化硫,污染空气,形成雨,所以灼烧后的尾气要进行处理才能排放,隔膜电解三氯化锑的盐酸溶液在阳极获得五氯化锑溶液,阳极上氯离子会不够,阴极获得锑和氢气,阴极会有多余的氯离子,所以溶液中氯离子应从阴极向阳极运动,五氯化锑溶液中加入辉锑矿(Sb2S3)发生氧化还原反应得到硫单质,过滤后得到氯化锑溶液中含氯化砷、氯化铜等杂质,加入锑的还原剂可得粗锑,过滤后的得废液中含有氯化砷、氯化铜,通过硫化生成硫化铜除铜,加入还原剂可除砷,据此答题.
解答 解:(1)从辉锑矿提取锑的传统工艺是:先现在空气中灼烧辉锑矿粉,然后用热还原法冶炼锑,传统工艺在空气中灼烧辉锑矿粉,会生成二氧化硫,污染空气,易导致酸雨,所以灼烧后的尾气要进行处理才能排放,
故答案为:易导致酸雨;先处理,后排放;
(2)隔膜电解三氯化锑的盐酸溶液在阳极获得五氯化锑溶液,阳极上氯离子会不够,阴极获得锑和氢气,阴极会有多余的氯离子,所以溶液中氯离子应从阴极向阳极运动,所以宜采用 阴离子交换膜,阳极的电极反应式为 Sb3+-2e-=Sb5+,
故答案为:阴离子; Sb3+-2e-=Sb5+;
(3)五氯化锑溶液中加入辉锑矿(Sb2S3)发生氧化还原反应得到硫单质,反应的主要化学方程式为Sb2S3+3SbCl5=5SbCl3+3S,
故答案为:Sb2S3+3SbCl5=5SbCl3+3S;
(4)以次磷酸钠(Na3PO2)做还原剂,使AsCl3被还原为棕色单质砷沉淀,此过程中磷从+1价变为+5价,化合价升高4价,砷从+3价变为0价,根据化合价升降总数相等结合原子守恒可配平,该反应的化学方程式为2AsCl3+3Na3PO2+3HCl+3H2O=2As↓+3H3PO3+9NaCl,
故答案为:2、3、3、3、2、3、9;
(5)根据上面的分析可知,步骤⑤为加入硫化物生成硫化铜除铜,可用Na2S溶液,故答案为:Na2S.
点评 本题考查了物质分离提纯综合应用、电化学的相关知识,综合性较强,考查的知识点较广泛,侧重考查学生对原理的分析理解,需要学生具备扎实的基础要注意知识点之间的联系,分析问题要细致,题目难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
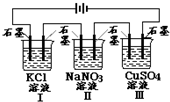 如图装置电解一段时间,当某极析出0.32g Cu时,I、Ⅱ、Ⅲ中溶液pH分别为(溶液足量,体积均为100mL且电解前后溶液体积变化忽略不计)( )
如图装置电解一段时间,当某极析出0.32g Cu时,I、Ⅱ、Ⅲ中溶液pH分别为(溶液足量,体积均为100mL且电解前后溶液体积变化忽略不计)( )| A. | 12、7、2 | B. | 13、7、1 | C. | 1、7、13 | D. | 7、13、1 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 A、B、C、D、E五种物质在一定条件下的转化关系如图所示.
A、B、C、D、E五种物质在一定条件下的转化关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体.
连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com