
| A、常温下,16g CH4含NA个H原子 |
| B、1 mol Fe与足量稀HNO3反应,转移3NA个电子 |
| C、0.1 mol/L NaHCO3溶液中含有0.1NA个Na+ |
| D、常温常压下,22.4L的NO2和CO2混合气体含有2NA个O原子 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
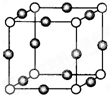 X+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体的晶胞结构如图所示.下列分析不正确的是( )
X+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体的晶胞结构如图所示.下列分析不正确的是( )| A、X+离子为K+ |
| B、该晶体中白色球代表N3- |
| C、阴阳离子的半径比是决定离子晶体结构的重要因素 |
| D、N3-填入X+构成的正八面体空隙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过滤法 | B、萃取法 |
| C、分液法 | D、冰冻法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所有物质中都含有化学键 |
| B、共价化合物中可能含离子键 |
| C、完全由非金属元素组成的化合物一定是共价化合物 |
| D、离子化合物中可以含共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、第一电离能由大到小的顺序为O>N>C |
B、由于C22-和O22+为等电子体,所以可以判断O22+的电子式为 |
| C、NO3-中N采用sp2杂化,故NO3-的空间构型为三角锥形 |
| D、液态HF通常也可以写成(HF)n的形式,是因为液态HF分子间存在氢键. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol碳原子数为4的烯烃,核外电子总数为24 NA |
| B、2.24L CO2与过量Na2O2反应,转移的电子总数为0.2 NA |
| C、足量的铜与含2mol H2SO4的浓硫酸充分反应,可生成NA个SO2分子 |
| D、室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com