
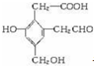
 ,试回答:
,试回答:分析 (1)由A的结构简式,可知含有的官能团有羧基、酚羟基、醇羟基、醛基,醛基能发生银镜反应;
(2)羧基、酚羟基、醇羟基均与Na反应,而羧基、酚羟基与氢氧化钠反应,只有羧基能与碳酸氢钠反应.
解答 解:(1)由A的结构简式,可知含有的官能团有羧基、酚羟基、醇羟基、醛基,其中能发生银镜反应的官能团是醛基,
故答案为:羧基、酚羟基、醇羟基、醛基;醛基;
(2)羧基、酚羟基、醇羟基均与Na反应,1mol该有机物可以跟3molNa反应,而羧基、酚羟基与氢氧化钠反应,1mol该物质能与2molNaOH反应,只有羧基能与碳酸氢钠反应,1mol该物质能与molNaHCO3反应,
故答案为:3;2;1.
点评 本题考查有机物的结构与性质,熟练掌握官能团的结构与性质即可解答,旨在考查学生对基础知识的掌握.


科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ① | ⑦ | ④ | ||||
| 3 | ③ | ⑤ | ⑧ | ⑩ | ||||
| 4 | ② | ⑨ |
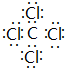 .
. ;④⑧⑨元素的离子的还原性由强到弱顺序为Br->Cl->F-(用离子符号).
;④⑧⑨元素的离子的还原性由强到弱顺序为Br->Cl->F-(用离子符号).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C21H33COOC2H5 | B. | C21H31COOC2H5 | C. | C22H33COOC2H5 | D. | C22H39COOC2H5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油的分馏和煤的气化、液化都是物理变化 | |
| B. | 以淀粉为原料可制取乙酸乙酯 | |
| C. | 分子式为C4H9Cl的同分异构体有2种 | |
| D. | 聚乙烯、丙炔、裂化汽油都可以使溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
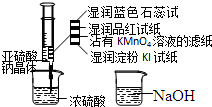 如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准).则下列有关说法正确的是( )
如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准).则下列有关说法正确的是( )| A. | 湿润淀粉碘化钾试纸未变蓝说明硫元素的非金属性强于碘元素 | |
| B. | 沾有KMnO4溶液的滤纸褪色证明了SO2具有漂白性 | |
| C. | 实验后,可把注射器中的物质缓缓推入NaOH溶液中,以减少环境污染 | |
| D. | 蓝色石蕊试纸变红说明SO2溶于水显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 有关性质或结构信息 |
| A | 负二价的A元素的氢化物在通常状况下是一种液体,其中A的质量分数为88.9% |
| B | B原子得到一个电子后3p轨道全充满 |
| C | C原子的p轨道半充满,它的气态氢化物能与其最高价氧化物的水化物反应生成一种常见的盐X |
| D | D元素的最高化合价与最低化合价的代数和为零,其最高价氧化物为分子晶体 |
| E | E的单质是日常生活中用量最大的金属材料 |
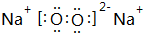
 .写出该阳离子与硫的氢化物的水溶液反应出现黄色浑浊的离子方程式:2H2O++H2S=S↓+2H2O+2H+.
.写出该阳离子与硫的氢化物的水溶液反应出现黄色浑浊的离子方程式:2H2O++H2S=S↓+2H2O+2H+.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2 L SO3所含的分子数目为0.5NA | |
| B. | 1 molFe与过量的氯气反应,转移电子的数目为2 NA | |
| C. | 常温常压下,3.2 g O2和3.2 g O3所含氧原子数都是0.2NA | |
| D. | 50mL18.4mol•L-1的浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com