
����Ŀ�������ǵ绯ѧԭ����Ӧ�����⡣
��1����A��B��C��D���ֽ������±�װ��ͼ����ʵ�飮
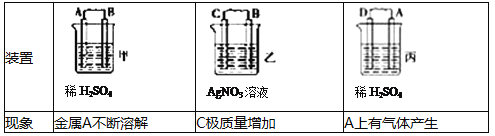
����ʵ������ش��������⣺���ֽ��������ǿ������˳������ ��
��2������ȼ�ϵ���Ƿ�����ɫ��ѧ��������ͷ���װ�á���ͼΪ���ʾ��ͼ��
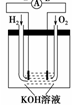
��ش�
������ȼ�ϵ�ص�����ת������Ҫ��ʽ����__________________��
�ڵ����е�����������Ϊ__________(��a��b��ʾ)��
��������ӦʽΪ____________________________��
��3����ͼ�е缫a��b�ֱ�ΪAg�缫��Pt�缫���缫c��d����ʯī�缫��ͨ��һ��ʱ�����c��d�����Ϲ��ռ���336mL����״�������壮�ش�
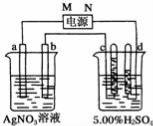
��ֱ����Դ�У�MΪ����������������
��AgNO3��Һ��Ũ�ȣ���������������С����������������ͬ����������
H2SO4��Һ��Ũ����������������
����ʱ��·��ת�Ƶ��ӵ����ʵ���Ϊ____________mol��
���𰸡���1��D��A��B��C
��2������ѧ��ת��Ϊ���� ��a��b
��2H2��4OH����4e��=4H2O(��H2��2OH����2e��=2H2O)
��3������ �����䡢��� 0.02
��������
�����������1����ԭ����нϻ��õĽ�����������ʧȥ���ӣ�����������Ӧ������A�����ܽ⣬A�Ǹ�����������A>B��C���������ӣ�C������������C��������������B>C��A�������������A��������������D>A�����Ի�����D��A��B��C��(2)������ȼ�ϵ�ص�����ת������Ҫ��ʽ���ɻ�ѧ��ת��Ϊ���ܣ�ȼ�ϵ���У���������������Ӧ��ͨ��ȼ�������ĵ缫�Ǹ������ڵ����е�����������Ϊ��a��b������������ʧ���ӵ�������Ӧ����2H2+4OH--4e-�T4H2O��H2+2OH--2e-�T2H2O����3������������֪���缫a��b��û���������ɣ���a��������bΪ����������M��ԭ�����������
���ڲ��缫�϶���ʱ�������ϵĵ缫��ӦʽΪAg-e-=Ag+�������ϵĵ缫��ӦʽΪAg++e-=Ag��������������Һ��Ũ�Ȳ��䣻���ϡ������Һʱ����������2H++2e-�TH2������������4OH--4e-�TO2��+2H2O��ʵ���ϵ�����ˮ����Һ�е����ʲ��䣬�ܼ����٣�����ϡ�����Ũ������
�����ϡ���ᷴӦʱ����ͨ��һ��ʱ���c��d�������ռ���336mL���壨��״����������������2H++2e-�TH2������������4OH--4e-�TO2��+2H2O��ʵ���ϵ�����ˮ����ط�ӦʽΪ��2H2O ![]() 2H2��+O2�������ݷ���ʽ֪���������������ռ�������
2H2��+O2�������ݷ���ʽ֪���������������ռ�������![]() �����Ի�������������������224mL������2H++2e-�TH2�� ֪��ת�Ƶ��ӵ����ʵ�����0.02mol����
�����Ի�������������������224mL������2H++2e-�TH2�� ֪��ת�Ƶ��ӵ����ʵ�����0.02mol����


 ��Ȥ����¹�֪��ϵ�д�
��Ȥ����¹�֪��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���ҴӺ���������ȡ��IJ������̣�����ѡ�ò���ȷ���ǣ� ��
A����ȡ3g���ҵĸɺ�������������ƽ
B�����ոɺ�������ȫ��ɻҽ�����������
C��������к�ĺ�����ˮ���Һ����©��
D�������Ȼ�̼��������ĺ����ҽ�ȡҺ����ȡ�⩁����Һ©��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ȼ�����ݳɷֲ�ͬ��Ϊƶ��������ƶ���м���ĺ����϶࣬���������顢���顢����ĺ�����Ը�һЩ����Ҫ������Һ��������˵����ȷ����
A��ƶ����Һ�� B��������Һ��
C������Һ��������ͬ D����ѹ���¾�����������Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڻ�ѧƽ�ⳣ����˵���У���ȷ����
A�����κ������£���ѧƽ�ⳣ������һ����ֵ
B����ѧƽ�ⳣ��K�����ƶ�һ�����淴Ӧ���еij̶�
C����ѧƽ�ⳣ��Kֻ���¶ȡ���Ӧ��Ũ�ȡ���ϵ��ѹǿ�й�
D�����ı䷴Ӧ���Ũ��ʱ����ѧƽ�ⳣ���ᷢ���ı�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�������ֻ��������ϵ�ͬ���칹�壬��ͬ���칹���е�ijһ�ֵ�һ�ȴ���ֻ��һ�֣���������������
�������о���7��̼ԭ�ӵķ�������
�������о���4��̼ԭ�ӵ�������
�������о���12����ԭ�ӵ�������
�������о���8��̼ԭ�ӵ�������
A���ۢ� B���٢� C���ڢ� D���ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʽΪC5H10O2�����뱥��NaHCO3��Һ��Ӧ�ų�������л����У���������ṹ��
A. 3�� B. 4�� C. 5�� D. 6��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����A��B�����������ǵ������ͬ����Լ��85.7%��̼����A������������ܶ���28����Bʽ������A��һ�뱶����A��B����ʹ������Ȼ�̼��Һ��ɫ����������ʵ����ʵ�ش����⣮
��1���ƶ�A��B�����Ļ�ѧʽ��
A ��B ��
��2��A��B�� ����A��B�Ľṹ��ʽ������ͬ���칹�壬ͬ���칹��������� ����дһ����
��3��д��B��������Ȼ�̼��Һ��Ӧ�Ļ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ClO2��Cl2�������������������ˮ�������߱��ʵȷ���Ӧ�ù㷺��ij��ȤС��ͨ��ͼ1װ��(�г�װ����)�����Ʊ������ա��ͷź�Ӧ�ý������о���
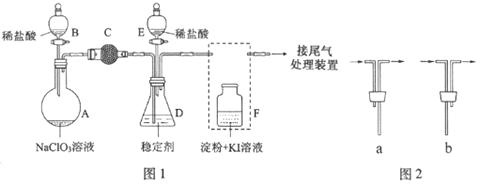
��1������D��������_______����װF�е���ʱ��Ӧѡ��ͼ2�е�___________��
��2����B�Ļ�����A�з�����Ӧ��2NaClO3+4HCl�T2ClO2��+Cl2��+2NaCl+2H2O��ΪʹClO2��D�б��ȶ���������գ��μ�ϡ������ٶ���___________(����������������)��
��3���ر�B�Ļ�����ClO2��D�б��ȶ�����ȫ��������NaClO2����ʱF����Һ����ɫ���䣬��װ��C��������___________��
��4����֪������������NaClO2�ɷ�����Ӧ����NaCl���ͷų�ClO2���÷�Ӧ�����ӷ���ʽΪ___________����ClO2�ͷ�ʵ���У���E�Ļ�����D�з�����Ӧ����װ��F��������___________��
��5��������ClO2������ȶ��������ȶ�������������ͷ�ClO2��Ũ����ʱ��ı仯��ͼ3��ʾ������������ˮ�����ʣ�����ΪЧ���Ϻõ��ȶ�����___________��ԭ����___________��
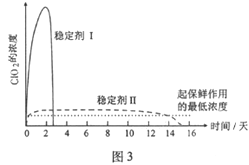
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������۷���Ϣ�صijɷ�֮һ�������㽶����ζ��ʵ��������������촼�Ʊ������������ķ�Ӧ��װ��ʾ��ͼ���й��������£�
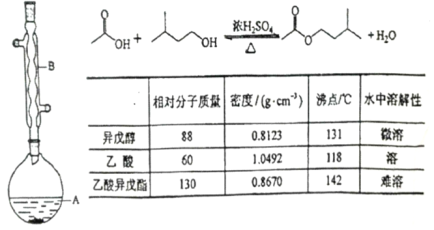
ʵ�鲽�裺
��A�м���4.4 g�����촼��6.0 g�����ᡢ����Ũ�����23Ƭ���Ƭ����ʼ��������A������50min����ӦҺ�������º����Һ©���У��ֱ�������ˮ������̼��������Һ��ˮϴ�ӣ��ֳ��IJ������������ˮMgSO4�� ���壬����Ƭ�̣����˳�ȥMgSO4���壬�����������ռ�140143����֣�������������3.9g.
�ش��������⣺
��1��װ��B�������� �������� .
��2�����Ƭ�������� .
��3����ϴ�Ӳ����У���һ��ˮϴ����ҪĿ���� ���ڶ���ˮϴ����ҪĿ���� .
��4����ϴ�ӡ���Һ�����У�Ӧ�����Ȼ���ã����ֲ��_________
A��ֱ�ӽ������������ӷ�Һ©���Ͽڵ���
B��ֱ�ӽ������������ӷ�Һ©���¿ڷų�
C���Ƚ�ˮ��ӷ�Һ©�����¿ڷų����ٽ��������������¿ڷų�
D���Ƚ�ˮ��ӷ�Һ©�����¿ڷų����ٽ��������������Ͽڵ���
��5��ʵ���м���������ˮMgSO4��Ŀ���� .
��6����ʵ��IJ����� .a��30% b��40% c��50% d��60%
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com