
| A. | 若X为非气态,则正反应为放热反应 | |
| B. | 若正反应为放热反应,则X为气态 | |
| C. | 在平衡混合物中加入少量Z(s),则平衡向左移动 | |
| D. | 压强变化对该平衡没有影响 |
分析 达到化学平衡后,升高温度,容器内气体的密度增大,说明气体的质量增大,若平衡向正反应方向移动,则X应为非气态,若平衡向逆反应方向移动,则X应为气态,
A、升高温度,气体的质量增大,气体的密度才增加,据此回答;
B.若正反应为放热反应,升高温度平衡向逆反应移动,气体的质量增大,据此判断X的状态;
C、固体量的增减不会引起平衡的移动;
D.压强对于化学反应前后气体物质的量变化的反应有影响.
解答 解:达到化学平衡后,升高温度,容器内气体的密度增大,说明气体的质量增大,若平衡向正反应方向移动,则X应为非气态,若平衡向逆反应方向移动,则X应为气态,
A、X为非气态,反应中只有Y为气体,升高温度,Y的质量增大,平衡应向正反应移动,故正反应为吸热反应,故A错误;
B.若正反应是放热反应,升高温度平衡向逆反应方向移动,容器内气体的密度增大,说明气体的质量增大,则X应为气态才能符合,故B正确;
C.在平衡混合物中加入少量Z(s),则平衡不会移动,故C错误;
D.反应中存在气体,所以压强变化会影响平衡的移动,故D错误;
故选B.
点评 本题考查化学平衡的影响因素,题目难度中等,明确容器内气体密度的变化、气体质量的变化是关键.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清透明的溶液中:Cu2+、Fe3+、NO3-、Cl- | |
| B. | 使红色石蕊试纸变蓝的溶液中:NH4+、Na+、SO42-、Cl- | |
| C. | 含有大量ClO-的溶液中:K+、OH-、I-、SO32- | |
| D. | c(Fe3+)=0.1 mol•L-1的溶液中:K+、ClO-、SO42-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

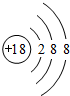 ,非金属性最强的元素是F,最高价氧化物的水化物碱性最强的碱的电子式是
,非金属性最强的元素是F,最高价氧化物的水化物碱性最强的碱的电子式是 ,最高价氧化物的水化物酸性最强的酸的化学式是HClO4;
,最高价氧化物的水化物酸性最强的酸的化学式是HClO4; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2O2 $\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑ | B. | CaCO3+2HCl═CaCl2+H2O+CO2↑ | ||
| C. | Zn+H2SO4═ZnSO4+H2↑ | D. | Cl2+H2O═HCl+HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 资料表明,硫粉与热的KOH溶液共热生成两种盐,其中一种是K2 SO3.某化学兴趣小组进行该实验时,却检测到生成的盐中含有SO42-.
资料表明,硫粉与热的KOH溶液共热生成两种盐,其中一种是K2 SO3.某化学兴趣小组进行该实验时,却检测到生成的盐中含有SO42-.| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| T/℃ | 50 | 60 | 70 | 80 | 90 |
| c/mol.L-1 | 1.0 | 3.0 |
| 实验方案(不要求写出具体操作过程) | 预期实验现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 福尔马林可用于保存海鲜产品 | |
| B. | 油脂在酸性条件下可水解生成高级脂肪酸和甘油 | |
| C. | 淀粉、油脂、氨基酸都能水解,但水解产物不同 | |
| D. | 合成橡胶与光导纤维都属于有机高分子材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚乙烯塑料的老化是由于发生了加成反应 | |
| B. | 等物质的量的苯和苯甲酸完全燃烧消耗氧气的量不相等 | |
| C. | 苯与甲苯互为同系物,均能使酸性KMnO4溶液褪色 | |
| D. | “可燃冰”主要成分是甲烷和水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com