
| 序号 | 硫酸的体积/mL | 锌的质量/g | 锌的性状 | 温度/ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
| 1 | 50.0 | 2.0 | 薄片 | 25 | 100 | m1 |
| 2 | 50.0 | 2.0 | 颗粒 | 25 | 70 | m2 |
| 3 | 50.0 | 2.0 | 颗粒 | 35 | 35 | m3 |
| 4 | 50.0 | 2.0 | 粉末 | 25 | 45 | 5.0 |
| 5 | 50.0 | 6.0 | 粉末 | 35 | 30 | m4 |
| 6 | 50.0 | 8.0 | 粉末 | 25 | t6 | 16.1 |
| 7 | 50.0 | 10.0 | 粉末 | 25 | t7 | 16.1 |
分析 (1)根据决定化学反应速率的本质因素进行解答;根据实验2和实验3的反应条件进行分析;温度越高,反应速率会越快;
(2)研究锌的形状对反应速率的影响时,除了锌的规格不同外,其它条件必须完全相同;反应物的接触面积越大,反应速率越快;
(3)根据加入少量硫酸铜,可以构成原电池,即可了反应速率进行解答;
(4)根据加入8g锌和加入10g锌生成的硫酸锌质量相同可知,该两种条件下硫酸完全反应,据此计算出硫酸锌的物质的量及硫酸的物质的量浓度.
解答 解:(1)化学反应速率本质上是由反应物本身的性质决定的;实验2和实验3中,除了温度不同外,其它条件完全相同,则说明探究的是温度对反应速率的影响;温度越高,反应速率越快,
故答案为:反应物本身的性质;温度;
(2)根据表中数据可知,实验1、2和4中,除了锌的形状不同外,其它条件完全相同,则它们是探究锌的形状对反应速率的影响;固体的接触面积越大,反应速率越快,
故答案为:1、2和4;接触面积越大;
(3)若采用与实验1完全相同的条件,但向反应容器中滴加少量硫酸铜溶液,由于锌会置换出少量的金属铜,在该条件下构成了原电池,所以反应速率明显加快,
故答案为:锌会置换出少量的金属铜,在该条件下构成了原电池,加快了反应速率;
(4)根据实验6和实验7可知,加入8g锌后与加入10g锌生成的硫酸锌质量相同,说明两个实验中硫酸完全反应,16.1g硫酸锌的物质的量为:$\frac{16.1g}{161g•mo{l}^{-1}}$=0.1mol,则原硫酸溶液的物质的量浓度为:$\frac{0.1mol}{0.05L}$=2mol/L,
故答案为:2.
点评 本题考查了探究影响化学反应速率的因素,题目难度中等,注意掌握温度、浓度、催化剂、原电池等对化学反应速率的影响,明确探究影响化学反应速率的因素的方法.


科目:高中化学 来源: 题型:选择题
| A. | 9 | B. | 8 | C. | 17 | D. | 25 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
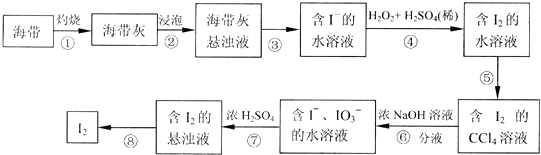
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
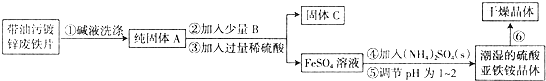
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
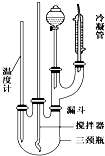 硝基苯是一种重要的化工原料,其制备原理是:
硝基苯是一种重要的化工原料,其制备原理是: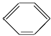 +HO-NO2$→_{50~60℃}^{H_{2}SO_{4}}$
+HO-NO2$→_{50~60℃}^{H_{2}SO_{4}}$ 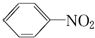 +H2O△H<0
+H2O△H<0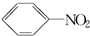 +HO-NO2$→_{△}^{H_{2}SO_{4}}$
+HO-NO2$→_{△}^{H_{2}SO_{4}}$ 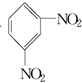 +H2O
+H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它位于周期表的第四周期、第ⅠA族 | |
| B. | 在钠、钾、铷三种单质中,相同条件下铷与水的反应速率最小 | |
| C. | 氢氧化铷是弱碱 | |
| D. | 硝酸铷是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
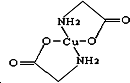 Cu及其化合物在科学研究和工业生产中具有许多用途.请回答以下问题:
Cu及其化合物在科学研究和工业生产中具有许多用途.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 一定条件下,使用催化剂能加快反应速率和提高反应物转化率 | |
| B. | 常温下,向水中滴加少量酸形成稀溶液,溶液中c(OH-)和水的离子积常数Kw均不变 | |
| C. | 在锌与足量稀硫酸反应溶液中加入少量铜粉溶液,可以加快反应速率但不影响产生氢气的量 | |
| D. | 在密闭绝热的容器中发生2SO2+O2?2SO3反应,当反应容器温度恒定时,反应达到平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸的实验式:C2H4O2 | B. | 苯乙醛的结构简式: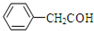 | ||
| C. | 乙烯的结构简式:CH2CH2 | D. | 丙烷分子的球棍模型: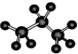 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com