
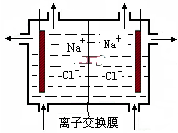
| A. | 离子交换膜既能让Na+通过,又能让OH-通过 | |
| B. | 阳极产生氯气和氢氧化钠 | |
| C. | 阴极区要定时添加饱和食盐水 | |
| D. | 阴极区流出的是氢氧化钠和氯化钠的混合溶液 |
分析 A、依据装置图可知,离子交换膜是阳离子交换膜;
B、水电离产生的氢离子在阴极放电,同时产生氢氧根离子;
C、阳极周围是氯子放电,所以在阳极周围添加饱和食盐水;
D、阴极是水电离产生的氢离子放电,所以流出的氢氧化钠和氯化钠的混合液.
解答 解:A、依据装置图可知,离子交换膜是阳离子交换膜,只允许阳离子通过,故A错误;
B、水电离产生的氢离子在阴极放电,同时产生氢氧根离子,所以氢氧化钠在阴极产生,故B错误;
C、阳极周围是氯子放电,所以在阳极周围添加饱和食盐水,而不是阴极,故C错误;
D、阴极是水电离产生的氢离子放电,所以流出的氢氧化钠和氯化钠的混合液,故D正确;
故选D.
点评 本题考查了电解原理的分析应用,电极判断,电极反应分析,掌握电解原理是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. |  与 与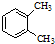 是同分异构体 是同分异构体 | |
| B. | 苯可以发生加成反应 | |
| C. | 可通过萃取的方法,从煤中提取苯 | |
| D. | 向2mL苯中加入1mL酸性高锰酸钾溶液,震荡后静置,可观察到液体分层,上层呈紫红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
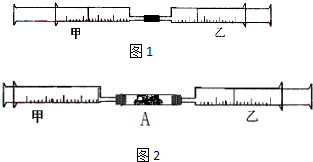 如图1所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质缓缓地压到甲针筒内,进行下表所列的不同实验(气体体积在常温常压下测定).
如图1所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质缓缓地压到甲针筒内,进行下表所列的不同实验(气体体积在常温常压下测定).| 实验序号 | 甲针筒内物质 | 乙针筒内物质 | 甲针筒的现象 |
| 1 | 40mL HCl | 40mL NH3 | 产生白烟 |
| 2 | 40mL Cl2 | 10mL 水 | 剩余气体为20mL |
| 3 | 30mL NO | 15mL O2 | |
| 4 | 20mL AlCl3溶液 | 10mL NaOH溶液 | 生成白色沉淀,后消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2中混有少量SO3,通过足量浓硫酸,收集气体 | |
| B. | HNO3溶液中混有少量H2SO4,加入适量BaCl2溶液,再过滤 | |
| C. | 提取溴水中的溴,可用加入乙醇萃取的方法 | |
| D. | 检验溶液中是否含有Fe2+,向溶液中滴入氯水后,再滴加KSCN溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com