Ⅰ.下列叙述正确的是______.
A.“接触法”制H
2SO
4时,催化氧化阶段的反应原理为2SO
2(g)+O
2(g)
2SO
3(g)△H<0
B.海水提镁的主要步骤为:
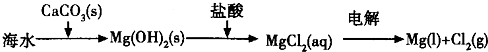
C.普通水泥的主要成分是硅酸钙
D.黏土的主要成分是三氧化二铝
Ⅱ.工业上可用食盐和石灰石为主要原料,经不同的方法生产纯碱.请回答下列问题:
(1)路布兰法是以食盐、石灰石、浓硫酸、焦炭为原料,在高温下进行煅烧,再浸取、结晶而制得纯碱.
①食盐和浓硫酸反应的化学方程式为______;
②硫酸钠和焦炭、石灰石反应的化学方程式为______(已知产物之一为CaS);
(2)氨碱法的工艺如图1所示,得到的碳酸氢钠经煅烧生成纯碱.
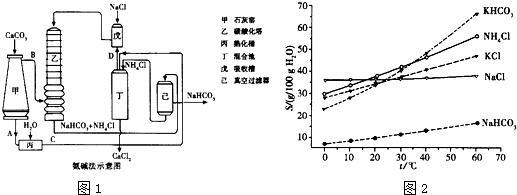
①图中的中间产物C是______,D是______(写化学式);
②装置乙中发生反应的化学方程式为______;
(3)联合制碱法是对氨碱法的改进,其优点是______;
(4)有人认为碳酸氢钾与碳酸氢钠的化学性质相似,故也可用氨碱法以氯化钾和石灰石等为原料制碳酸钾.请结合图1的溶解度(S)随温度变化曲线,分析说明是否可行?______.





 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案