
����Ŀ����5�ֶ�����Ԫ�ص�ԭ��������E��D��B��A��C ��˳���������� A��C ͬ���ڣ�B��Cͬ���壻A��B ���γ����ӻ�����A2B��A2B ���������ӵĵ��Ӳ�ṹ��ȫ��ͬ���ҵ�������Ϊ30��D ��E���γ�4 ��10 ���ӵķ��ӡ��Իش���������:
��1��д���������ʵĵ���ʽ:
��DԪ���γɵĵ���___________��
��B��E �γɵ���ԭ�ӻ�����___________��
��A��B��E �γɵĻ�����___________��
��D��E �γɵļ�����___________��
��2��B��D��E�γɵ�ԭ�Ӹ���3�U2�U4���εĻ�ѧʽΪ_______���������______����������ӻۣ������еĻ�ѧ������__________��
���𰸡�![]()
![]()
![]()
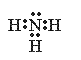 NH4NO3 ���� ���Ӽ����ۼ���
NH4NO3 ���� ���Ӽ����ۼ���
��������
��5�ֶ�����Ԫ�ص�ԭ��������E��D��B��A��C ��˳����������D��E���γ�4��10���ӵķ��ӿ�֪���������NH3��D��NԪ�أ�E��HԪ�أ���A2B���������ӵĵ��Ӳ�ṹ��ȫ��ͬ���ҵ�������Ϊ30��֪��A��NaԪ�أ�B��OԪ�أ���B��Cͬ�����֪��C��SԪ�ء�
��1����DԪ���γɵĵ����ǵ����������ĵ���ʽΪ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
��B��E �γɵ���ԭ�ӻ������ǹ������⣬��������Ϊ���ۻ��������ʽΪ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
��A��B��E �γɵĻ�����Ϊ�������ƣ���������Ϊ���ӻ��������ʽΪ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
��D��E �γɵļ�����Ϊ����������Ϊ���ۻ��������ʽΪ ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
��2��B��D��E�γɵ�ԭ�Ӹ���3�U2�U4����Ϊ����泥���ѧʽΪNH4NO3��NH4NO3�� ��笠�����������������γɵ����ӻ�����������к������Ӽ����ۼ����ʴ�Ϊ��NH4NO3�����ӣ����Ӽ����ۼ���


 ���Ͱ�ͨ��ĩ���ϵ�д�
���Ͱ�ͨ��ĩ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����(����)
A. ͬ����ǽ���Ԫ�صļ������ӵĻ�ԭ��Խǿ����Ԫ�طǽ�����Խǿ
B. ��A�����A��Ԫ�ؼ���γɹ��ۻ���������ӻ�����
C. Ԫ��ԭ�ӵ���������������Ԫ�ص�����ϼ�
D. ȫ���ɷǽ���Ԫ����ɵĻ�������ֻ�����ۼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����(����)
A.����ֻ�����ۣ��ǽ���ֻ�и���
B.�������ۣ������������
C.����Ԫ�ص�������۵�����ԭ������������
D.ͬ����Ԫ�ص�����������Խ�࣬ԭ�Ӱ뾶Խ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��µĺ����ܱ������У���������Щ���������ٷ����仯ʱ������������Ӧ��A(s) �� 2B(g)![]() C(g) �� D(g) �Ѵﵽƽ��״̬��
C(g) �� D(g) �Ѵﵽƽ��״̬��
����������ѹǿ �����������ܶ�
��B�����ʵ���Ũ�� ������������ʵ���
���������������
A. �ڢۢ� B. �٢ڢ� C. �ڢۢ� D. �٢ۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������½�NaOH��Һ���ӵ������ᣨH2X����Һ�У������Һ��pH������Ũ�ȱ仯�Ĺ�ϵ��ͼ��ʾ�����������������
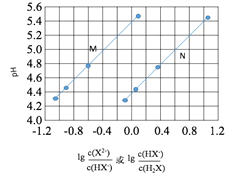
A. Ka2��H2X����������Ϊ10-6
B. ����N��ʾpH�� �ı仯��ϵ
�ı仯��ϵ
C. NaHX��Һ��c(H��)��c(OH��)
D. �������Һ������ʱ��c(Na��)��c(HX-)��c(X2-)��c(H+)=c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йص���ʵ�˵������ȷ���ǣ� ��
A.�������ƹ�������ˮ���ܵ��磬�������������ǵ����
B.������̼ˮ��Һ�ܹ����磬���Զ�����̼�ǵ����
C.����ͭ�ܵ��磬��������ͭΪ�����
D.�Ȼ�����Һ�ܹ����磬�����Ȼ�����Һ�ǵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��Ԫ�����ڱ���һ���֣�������������ȷ����
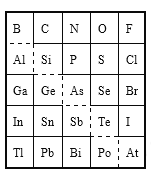
A. Sn���������Ϊ+4
B. Br������������Ӧˮ����Ļ�ѧʽΪHBrO3
C. ����ǿ����H3AsO4<H2SeO4
D. ԭ�Ӱ뾶�Ƚϣ�N<Si
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ���ҵ��ˮ�м�����Ⱦ�T����������ŷ�Ũ�����±�������˵������ȷ����

A. Hg2+��Cd2+��Pb2+���ؽ�������
B. ����pH>9�ķ�ˮ�����кͷ�����
C. ��CrO42-ת��ΪCr2O72-����������ԭ�ķ���
D. �ں���Hg2+�ķ�ˮ�м���Na2S����ʹת��Ϊ��������ȥ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������ͬ���������͵����������ǣ� ��
A. CH4
B. NH4+
C. Cl��
D. NH2��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com