
分析 根据所得溶液浓度及体积可计算出18.6g该有机物的物质的量,然后根据M=$\frac{m}{n}$可计算出该有机物的摩尔质量、相对分子质量;浓硫酸增重为水的质量,碱石灰增重的质量为二氧化碳的质量,分别根据n=$\frac{m}{M}$计算出生成水和二氧化碳的物质的量,然后利用质量守恒定律计算出该有机物分子中含有C、H原子数,最后根据其相对分子质量计算出含有氧原子数目,从而得出其分子式.
解答 解:150mL 2mol/L的溶液中含有溶质的物质的量为:2mol/L×0.15L=0.3mol,说明18.6g该有机物的物质的量为0.3mol,则该有机物的摩尔质量为:$\frac{18.6g}{0.3mol}$=62g/mol,其相对分子质量为62;
浓硫酸增重的为水的质量,则水的物质的量为:n(H2O)=$\frac{16.2g}{18g/mol}$=0.9mol,则该有机物分子中含有H原子数为:$\frac{0.9mol×2}{0.3mol}$=6,
碱石灰增重的质量为二氧化碳,生成二氧化碳的物质的量为:n(CO2)=$\frac{26.4g}{44g/mol}$=0.6mol,该有机物分子中含有C原子的数目为:$\frac{0.6mol}{0.3mol}$=2,
则该有机物分子中含有氧原子的数目为:$\frac{62-12×2-1×6}{16}$=2,
所以该有机物的分子式为:C2H6O2,
答:该有机物的分子式为C2H6O2.
点评 本题考查了有机物分子式确定的计算,题目难度中等,明确相对分子质量与摩尔质量的关系为解答关键,注意掌握质量守恒定律在确定有机物分子式中的应用,试题培养了学生的分析能力及化学计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ①⑥ | B. | ①④⑥ | C. | ①⑤ | D. | ①⑤⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液的导电性与溶液中离子的浓度有关 | |
| B. | 溶液的导电性与溶液中离子数目的多少有关 | |
| C. | 灯泡最暗时溶液中无自由移动的离子 | |
| D. | 往氢氧化钡溶液中滴加盐酸与滴加硫酸时现象相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
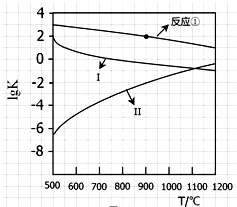 用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应.
用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
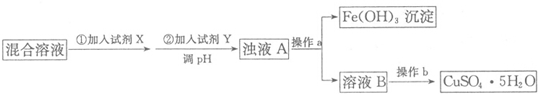
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 1.9 | 6.5 | 4.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱金属氟化物的晶格能顺序是LiF>NaF>KF>RbF>CsF;则钠的卤化物的晶格能顺序是NaF>NaCl>NaBr>NaI | |
| B. | ⅣA族元素氢化物沸点顺序是GeH4>SiH4>CH4;则ⅤA族元素氢化物沸点顺序是AsH3>PH3>NH3 | |
| C. | 晶体中有阴离子,必有阳离子;则晶体中有阳离子,必有阴离子 | |
| D. | 若盐酸的浓度是醋酸浓度的2倍;则盐酸中H+浓度也是醋酸中H+浓度的2倍 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com