
��CO2��NH3Ϊԭ�Ͽɺϳɻ�������[��ѧʽΪCO(NH2)2]����֪��
��2NH3(g)+CO2(g)��NH2CO2 NH4(s) +l59.5 kJ·mol-1
��NH2CO2NH4(s) ��CO(NH2)2(s)+H2O(g) -116.5 kJ·mol-1
��H2O(1) ��H2O(g) -44.0kJ·mol-1
д��CO2��NH3�ϳ����غ�Һ̬ˮ���Ȼ�ѧ��Ӧ����ʽ

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��SO2����������Fe2(SO4)3��Һ��ȫ��Ӧ���ټ���K2Cr2O7��Һ����������������ѧ��Ӧ��
��SO2+2Fe3++2H2O=SO42-+2Fe2++4H+
��Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
�����й�˵���������
A��������Cr2O72->Fe3+>SO2
B��K2Cr2O7�ܽ�Na2SO3������Na2SO4
C��ÿ��1molK2Cr2O7�μӷ�Ӧ��ת�Ƶ��ӵ���ĿΪ6NA
D����6.72 L SO2(��״��)�μӷ�Ӧ������������0.2molK2Cr2O7
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������������������������ܹ��������·�Ӧ��
MnO4- + H2C2O4 + H+ —— Mn2+ + CO2��+ H2O��δ��ƽ��
��ͬѧ�о�������ضԷ�Ӧ����Ӱ�죬�������ʵ�鷽����
��4 mL 0.001 mol/L KMnO4��Һ��2 mL 0.01 mol/L H2C2O4��Һ���о���ͬ�����Ի�ѧ��Ӧ���ʵ�Ӱ�졣�ı���������£�
| ��� | 10%�������/mL | �¶�/�� | �������� |
| A | 2 mL | 20 | |
| B | 2 mL | 20 | 10�α���MnSO4��Һ |
| C | 2 mL | 30 | |
| D | 1 mL | 20 | V1 mL����ˮ |
| E | 0.5 mL | 20 | V2 mL����ˮ |
(1)�������ʵ�鷽����ƣ����У� V1= ��V2= ��
(2) ����о��¶ȶԻ�ѧ��Ӧ���ʵ�Ӱ�죬ʹ��ʵ�� �� ��
(3) ��ͬѧ����A��ʵ��ʱ�����ַ�Ӧ��ʼʱ���ʽ��������ӿ졣��������Ϊ���������
������Һ�ķ�Ӧ���ȣ�������Һ�¶����ߣ���Ӧ���ʼӿ죻��Ӱ�컯ѧ��Ӧ���ʵ����ؿ���
����뻹������ ��
����ͬѧ������ͼ�ⶨ��Ӧ����

�ش���������
��4��ʵ��ʱҪ���װ�õ������ԣ����������ķ����� ��
��5����ͬѧͨ��������ͬ�����CO2����ʾ��Ӧ�����ʣ���Ҫ ������¼���ݡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��SO2����������Fe2(SO4)3��Һ��ȫ��Ӧ���ټ���K2Cr2O7��Һ����������������ѧ��Ӧ��
��SO2+2Fe3++2H2O=SO42-+2Fe2++4H+
��Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
�����й�˵���������
A��������Cr2O72->Fe3+>SO2
B��K2Cr2O7�ܽ�Na2SO3������Na2SO4
C��ÿ��1molK2Cr2O7�μӷ�Ӧ��ת�Ƶ��ӵ���ĿΪ6NA
D����6.72 L SO2(��״��)�μӷ�Ӧ������������0.2molK2Cr2O7
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����ڹ�ũҵ����������ҪӦ�á�
��ԭ�ӵ������ĵ����Ų�ʽ��______________����ԭ�Ӻ����_______�ֲ�ͬ�����ĵ��ӡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ������M��ij�ֽ�����ʹҩ����AΪԭ�ϵĹ�ҵ�ϳ�·������ͼ��ʾ��
������M��ij�ֽ�����ʹҩ����AΪԭ�ϵĹ�ҵ�ϳ�·������ͼ��ʾ��
|
 ��֪��
��֪��

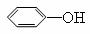 �� +
�� +  + CH3COOH
+ CH3COOH

���������գ�
д����Ӧ���ͣ� ��Ӧ�� ��Ӧ�� ��
A�ṹ��ʽ�� ����A�ϳ�D������Ҫ �����������ɡ�
д����Ӧ�ܵĻ�ѧ����ʽ��
��
B���б����ṹ��ͬ���칹������һ������NaOH(aq)�з���ˮ�⡣1mol���л����������NaOH mol��д�����������������е�F��ͬ���칹��Ľṹ��ʽ��
����һ�ַ����廯��� ������-����� �۱�������4�ֲ�ͬ��������ԭ��
�� �� B����һ����ɣ�����Ϳ��ܵ�ԭ��
�� B����һ����ɣ�����Ϳ��ܵ�ԭ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
X��Y��ZΪ3�����壬��a mol X��b mol Y����һ�ܱ������У�������ӦX+2Y 2Z�ﵽƽ��ʱ�������ǵ����ʵ�������n(X)+n(Y)=n(Z)����Y��ת����Ϊ
2Z�ﵽƽ��ʱ�������ǵ����ʵ�������n(X)+n(Y)=n(Z)����Y��ת����Ϊ
A. ��100% B.
��100% B. ��100%
��100%
C.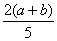 ��100% D.
��100% D. ��100%
��100%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������֪��448��ʱ����ӦH2��g��+I2��g�� 2HI��g����ƽ�ⳣ��K1Ϊ49������¶��� ��Ӧ
2HI��g����ƽ�ⳣ��K1Ϊ49������¶��� ��Ӧ H2��g��+
H2��g��+ I2��g��
I2��g�� HI��g����ƽ�ⳣ��K2Ϊ__________��
HI��g����ƽ�ⳣ��K2Ϊ__________��
������һ��������ܱ������У��������»�ѧ��Ӧ��CO2��g��+H2��g�� CO��g��+H2O��g�����仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���ʾ��
CO��g��+H2O��g�����仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���ʾ��
| t/�� | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
�ش��������⣺
��1)�÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪK=____________________��
��2)�÷�ӦΪ__________��Ӧ������ȡ����ȡ�����
(3�����жϸ÷�Ӧ�ﵽ��ѧƽ��״̬�������ǣ� ����
A.������ѹǿ���� B.���������C��CO������
C.V(H2)��=V(H2O)�� D. c��CO2����c��CO��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���������һ�����Ϳɳ���أ�����ͨ���ܵ����ȣ��õ���ܳ�ʱ�䱣���ȶ��ķŵ��ѹ��������ص��ܷ�ӦΪ��

������������ȷ����
A. �ŵ�ʱ������ӦΪ��Zn - 2e— + 2OH— == Zn��OH��2
B. ���ʱ������ӦΪ��Fe��OH��3 -3e— + 5OH— == FeO42— + 4H2O
C. �ŵ�ʱÿת��3moL���ӣ�������1 mol K2FeO4������
D. �ŵ�ʱ����������Һ�ļ�����ǿ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com