
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 1 | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 10 | 0.55 | 0.10 | 0.90 |
| 14 | 0.55 | 0.10 | 0.90 |

 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源:不详 题型:单选题
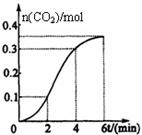
| A.反应开始2分钟内平均反应速率最大 |
| B.反应4分钟后平均反应速率最小 |
| C.反应开始4分钟内温度对反应速率的影响比浓度大 |
| D.反应4分钟后反应速率下降的原因是盐酸浓度逐渐减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
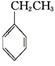 (g)+CO2(g)
(g)+CO2(g)
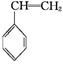 (g)+CO(g)+H2O(g)ΔH="-166" kJ·mol-1
(g)+CO(g)+H2O(g)ΔH="-166" kJ·mol-1
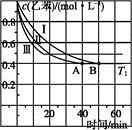
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
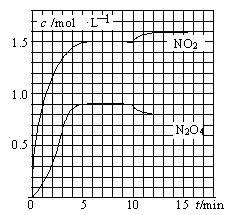
 2NO2(g)
2NO2(g) N2O4(g)
N2O4(g)| A.前5min反应的平均速率v(N2O4)=0.18mol·(L·min)-1 |
| B.T1℃时反应②的化学平衡常数K=0.6 |
| C.反应①、②均为吸热反应 |
| D.若起始时向该容器中充入3.6mol NO2和2.0mol N2O4,T1℃达到平衡时,N2O4的转化率为10% |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
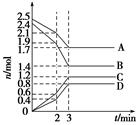
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2NH3,某段时间内的平均反应速率分别用v(N2)、v(H2)、v(NH3)表示(单位均为mol·L-1·s-1)时,下列关系式中正确的是( )
2NH3,某段时间内的平均反应速率分别用v(N2)、v(H2)、v(NH3)表示(单位均为mol·L-1·s-1)时,下列关系式中正确的是( )| A.v(H2)=v(NH3) | B.v(N2)=2v(NH3) |
| C.v(NH3)=v(H2) | D.v(H2)=3v(N2) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5 L | 0.5 L | 1.0 L |
| 温度/℃ | T1 | T2 | T3 |
| 反应物起始量 | 1.5 mol A 0.5 mol B | 1.5 mol A 0.5 mol B | 6.0 mol A 2.0 mol B |

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 HCOOH(l)+CH3OH(l) ΔH>0,某小组通过实验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表:
HCOOH(l)+CH3OH(l) ΔH>0,某小组通过实验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表:| 组分 | HCOOCH3 | H2O | HCOOH | CH3OH |
| 物质的量/ mol | 1.00 | 1.99 | 0.01 | 0.52 |
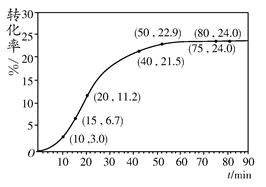
| 反应时间 范围/min | 0~5 | 10~15 | 20~25 | 30~35 | 40~45 | 50~55 | 75~80 |
| 平均反应速率 /(10-3 mol·min-1 | 1.9 | 7.4 | 7.8 | 4.4 | 1.6 | 0.8 | 0.0 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 pZ(g)+qQ(g)
pZ(g)+qQ(g)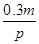 mol/(L·s),则2秒钟内Q物质增加了( )
mol/(L·s),则2秒钟内Q物质增加了( )A.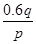 mol mol | B.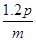 mol mol |
C.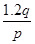 mol mol | D.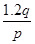 mol mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com