
分析 用4mol/L的标准盐酸配制0.1mol/L的盐酸500mL的配制的步骤为:计算、量取、稀释、冷却、转移、洗涤、定容、摇匀等,根据配制的步骤选择使用仪器即可.
解答 解:用4mol/L的标准盐酸配制500mL 0.1mol/L的盐酸的步骤为:计算、量取、稀释、冷却、转移、洗涤、定容、摇匀等,
根据配制步骤可知使用的仪器为:量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管,
故答案为:量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管.
点评 本题考查了配制一定物质的量浓度的溶液中选用仪器的方法,题目难度不大,注意掌握配制一定物质的量浓度的溶液的方法,能够根据配制步骤选择使用的仪器.


科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:Na+、K+、MnO4-、CO32- | |
| B. | 常温下c(H+)=1×10-13 mol•L-1的溶液中:Mg2+、Cu2+、SO42-、NO3- | |
| C. | 加入铝粉产生氢气的溶液:Na+、K+、SO42-、HCO3- | |
| D. | 透明溶液中:K+、Cu2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
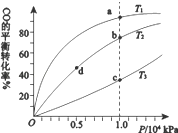
| A. | 温度:T1>T2>T3 | B. | 正反应速率:v(b)>υ(d)v(a)>υ(c) | ||
| C. | 平衡常数:K(a)>K(c) K(b)=K(d) | D. | 平均摩尔质量:M(b)>M(d)M(a)<M(c) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
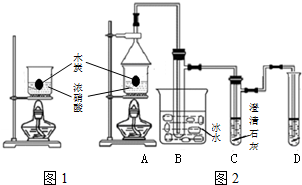 浓硝酸是一种常见的酸,加热或见光易分解生成NO2.某实验小组欲探究碳与浓硝酸的反应情况.实验装置如图.回答下列问题:
浓硝酸是一种常见的酸,加热或见光易分解生成NO2.某实验小组欲探究碳与浓硝酸的反应情况.实验装置如图.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,白磷(P4)的结构式为
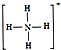
,白磷(P4)的结构式为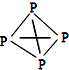 ,请画出N4H44+的结构式
,请画出N4H44+的结构式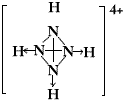 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol甲烷的质量与NA个甲烷分子的质量之和相等 | |
| B. | 28g氮气与40g氩气所含的原子数目相等,都是NA个 | |
| C. | 2.3g钠由原子变成离子,失去的电子数为0.1个 | |
| D. | 18g重水(D2O)所含的电子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com