
下列有关化学用语的表述正确的是( )
A.质子数为35、中子数为45的溴原子:
B.丙烷分子的球棍模型为: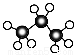
C.次氯酸的电子式为: 
D.—OH与OH- 组成元素相同,含有的电子数也相同
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源:2015-2016学年福建省漳州市高二下期末化学试卷(解析版) 题型:选择题
绿色化学的核心就是利用化学原理从源头上减少和消除工业生产对环境的污染。下列做法不符合绿色化学理念的是( )
A.研制水溶剂涂料替代有机溶剂涂料
B.用可降解塑料生产包装盒或快餐盒
C.用反应: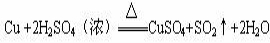 制备硫酸铜
制备硫酸铜
D.用反应: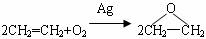 制备环氧乙烷
制备环氧乙烷
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高二下学期期末化学试卷(解析版) 题型:选择题
用纤维素为主要原料制备乙酸乙酯的路线如下:
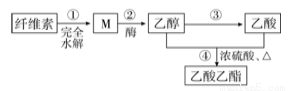
下列说法正确的是( )
A.若用淀粉替代纤维素,一定条件下也能按照此路线制备乙酸乙酯
B.M虽然分子结构中无醛基,但仍然可以发生银镜反应
C.步骤②,1molM完全反应可以生成3mol乙醇
D.③和④都发生了氧化还原反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省菏泽市高一下学期期末化学A卷(解析版) 题型:选择题
如图为一重要的有机化合物,以下关于它的说法中正确的是( )
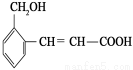
A.它是芳香烃
B.1mol该物质,最多可以与1mol H2发生加成反应
C.与1mol该物质反应,消耗Na、NaOH、NaHCO3 的物质的量之比为2 : 1 : 1
D.可以用酸性高锰酸钾溶液检验其中的碳碳双键
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省菏泽市高一下学期期末化学A卷(解析版) 题型:选择题
下列说法中正确的是( )
A. 甲烷中混有少量乙烯,可将混合气体通入盛有酸性高锰酸钾溶液的洗气瓶中除去
B. 在苯中加入酸性KMnO4溶液,振荡并静置后下层液体为紫色
C. 在苯中加入溴的四氯化碳溶液,振荡并静置后下层液体为无色
D. 食物中含有大量的纤维素,可以在人体内直接水解成葡萄糖成为营养物质
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南师大附中高一下学期末化学试卷(解析版) 题型:选择题
在铁和氧化铁混合物15 g中,加入稀硫酸150 mL,能放出H2 1.68 L(标准状况)。同时铁和氧化铁均无剩余,向反应后的溶液中滴入KSCN溶液,未见颜色变化。为了中和过量的H2SO4,且使Fe2+完全转化成Fe(OH)2,共消耗3 mol·L-1的NaOH溶液200 mL,则原硫酸的物质的量浓度是( )
A.1.5 mol·L-1 B.2 mol·L-1
C.2.5 mol·L-1 D.3 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南师大附中高一下学期末化学试卷(解析版) 题型:填空题
A、B、C、D为短周期元素,核电荷数依次增大,且A、B、C三种元素的原子核外电子层数之和为5。已知A是原子结构最简单的元素;B元素原子最外层上的电子数是其电子层数的2倍;A和C之间可形成A2C和A2C2两种化合物;D在同周期主族元素中原子半径最大,请回答下列问题。
(1)C元素在元素周期表中的位置是____________;写出BC2的结构式__________。
(2)C、D两种元素所形成的简单离子,半径由大到小的顺序是________________。(用离子符号表示)
(3)在恒温下,体积为2 L的恒容容器中加入一定量的B单质和1 mol A2C蒸汽,发生:B(s)+A2C(g)  BC(g)+A2(g)。2 min后,容器的压强增加了20%,则2 min内A2C的反应速率为__________。一段时间后达到平衡,下列说法正确的是__________。
BC(g)+A2(g)。2 min后,容器的压强增加了20%,则2 min内A2C的反应速率为__________。一段时间后达到平衡,下列说法正确的是__________。
A.增加B单质的量,反应速率加快
B.恒温恒容时在该容器中通入Ar,反应速率加快
C.气体的密度不再变化可以判断该反应达到了平衡
D.2 min时,A2C的转化率为80%
E.气体的平均摩尔质量不变时,该反应达到平衡
(4)BC与C2在DCA溶液中可形成一种燃料电池。该电池的负极反应式为:
________________________________________________________________________。
(5)写出D的单质与乙醇反应的化学方程式:
________________________________________________________________________。
(6)将0.2 mol D2C2投入到含有0.1 mol FeCl2的水溶液中恰好充分反应,反应的总的化学方程式为:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省眉山市高二下学期期末理综化学试卷(解析版) 题型:简答题
锰的单质及其化合物在生产、生活中有广泛应用。
(1)碱性锌锰电池广泛应用于日常生活。电池的总反应式为:Zn(s)+2MnO2(s)+2H2O(l)===Zn(OH)2(s)+2MnOOH(s)。该电池的正极反应式为 。
(2)某学习小组拟以废旧干电池为原料制取锰,简易流程如下:
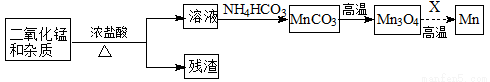
①加入浓盐酸溶解废旧电池内黑色物质过程中保持通风,其原因是 。
②从产品纯度、环保等角度考虑,X宜选择 (填代号)。
A.焦炭 B.铝 C.氢气 D.一氧化碳
③写出碳酸锰在空气中灼烧生成四氧化三锰的化学方程式 。
(3)电解硫酸锰溶液法制锰又叫湿法冶锰。以菱锰矿(主要成份是MnCO3,主要杂质是Fe2+、Co2+、Ni2+)为原料制备锰的工艺流程如下:

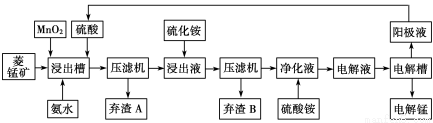
已知:NiS 、CoS均难溶于水。部分氢氧化物的pH如下表:(若某离子浓度小于等于10?5mol·L?1,则认为完全沉淀)
物质 | Fe(OH)2 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 | Fe(OH)3 |
开始沉淀pH | 7.5 | 7.7 | 7.6 | 8.3 | 2.7 |
完全沉淀pH | 9.7 | 8.4 | 8.5 | 9.8 | 3.8 |
①浸出槽内MnO2的作用是(用离子方程式表示) 。
②加入氨水调节浸出槽中溶液的pH范围为 。
③电解槽阴极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省天门、仙桃、潜江市高二下学期期末化学试卷(解析版) 题型:选择题
常温下,下列溶液的离子浓度关系式正确的是
A.pH=4的氯化铵溶液中:c(H+)= c(NH3·H2O )=1×10-4mol·L-1
B.pH=a的HCl溶液,稀释10倍后,其pH=b,则a=b-1
C.pH=2的HF溶液与pH=12的NaOH溶液以体积比1:1混合:c(Na+)=c(F-)>c(H+)=c(OH-)
D.pH相同的①NaOH、②NaClO两种溶液中水的电离程度:①<②
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com