
【题目】海水开发利用的部分过程如图所示。下列说法错误的是
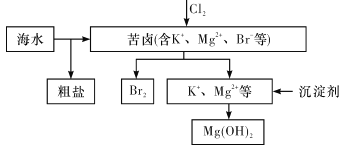
A. 向苦卤中通入Cl2是为了提取溴
B. 粗盐可采用除杂和重结晶等过程提纯
C. 工业生产中常选用NaOH作为沉淀剂
D. 富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
科目:高中化学 来源: 题型:
【题目】火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境问题。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:
CH4(g) + 4NO2(g) =4NO(g) + CO2(g) + 2H2O(g) △H1=-574 kJ·mol-1
CH4(g) + 4NO(g) =2N2(g) + CO2(g) + 2H2O(g) △H2=-1160 kJ·mol-1
甲烷直接将NO2还原为N2的热化学方程式为 。
(2)脱碳。将CO2转化为甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。

在体积为1L的固定容积的密闭容器中充入1 mol CO2和3 mol H2进行上述反应。测得CO2和CH3OH(g)浓度随时间变化如右图所示。试回答:
①0—10 min内,氢气的平均反应速率为___________mol/(L·min)。
②下列选项能说明该反应已达到平衡状态的是 。
A.v(H2)=3v(CO2)
B.容器内气体密度不变
C.单位时间内,形成2molC=O,同时断裂3molH—H
D.容器内温度不变
(3)脱硫。有学者想利用如下图所示装置用原电池原理将SO2转化为重要的化工原料,A、B是惰性电极。则电子流出的电极为____(用A或B表示),A极的电极反应式为_ ___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为说明氯比硫的非金属性强,下列事实可作依据的是
A. HCl的溶解性强于H2S
B. 氯的最高价为+7价
C. H2S中的S2-能被Cl2氧化
D. HClO的氧化性强于H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.1,2-二溴乙烷的结构简式为CH3CHBr2
B.乙酸乙酯的结构式为CH3-COO-CH2CH3
C.含有乙烯的乙烷通过催化加氢除去乙烯,可得到纯净的乙烷
D.完全燃烧生成等物质的量的 CO2和 H2O的物质不一定是乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“嫦娥一号”的四大科学目标之一是探测下列14种元素在月球上的含量和分布:K、Th(钍)、U(铀)、O、Si、Mg、Al、Ca、Fe、Ti(钛)、Na、Mn、Cr(铬)、Gd(钆),其中属于主族元素的有( )
A. 4种 B. 5种 C. 6种 D. 7种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向100ml0.01mol/LHA的溶液中逐滴加入0.02mol/LMOH溶液,如图所示,曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中不正确的是

A. HA为一元强酸,MOH为一元强碱
B. N点水的电离程度大于K点水的电离程度
C. 滴入MOH溶液的体积为50ml时,c(M+)>c(A-)
D. K点时,则有c(MOH)+(M+)=0.02mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能量是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
(1)已知:C(s)+O2(g)=CO2(g);ΔH=-437.3 kJ·mol-1
H2(g)+O2(g)=H2O(g);ΔH=-285.8 kJ·mol-1
CO(g)+O2(g)=CO2(g);ΔH=-283.0 kJ·mol-1
则煤气化反应C(s)+H2O(g)=CO(g)+H2(g)的焓变ΔH=________kJ·mol-1。
(2)熔融盐燃料电池具有高的发电效率,因而受到重视。可用熔融的碳酸盐作电解质。向负极充入燃料气CH4,用空气与 CO2 的混合气作为正极的助燃气,以石墨为电极材料,制得燃料电池。工作过程中, CO32-移向_________极(填“正”或“负”) ,已知 CH4 发生的电极反应式为 CH4 + 4CO32-―8e-= 5CO2+2H2O,则另一极的电极反应方程式为:
(3)利用上述燃料电池,按下图所示装置进行电解,A、B、C、D 均为铂电极,

A.甲槽中有200ml一定浓度的NaCl与C uSO4混合溶液,理论上两极所得气体的体积随时间变化的关系入上图所示(气体体积已换算成标准状况下的体积),(电解前后溶液的体积变化关系忽略不计)
①原混合溶液NaCl的物质的量浓度 mol/L, CuSO4的物质的量浓度 mol/L。
②t2时所得溶液的pH=___________
B.乙槽CuSO4 溶液200ml。乙槽内电解的总化学方程式________________;
①当 C 极析出 0.64g 物质时,乙杯溶液中生成的硫酸为_________mol。电解后,若使乙池内的溶液完全复原,可向乙池中加入_____________(选填字母标号)
A.Cu(OH)2 B.CuO C.CuCO3 D.Cu2(OH)2CO3
②若通电一段时间后,向所得的乙杯溶液中加入 0.2mol 的 Cu(OH)2 才能恰好恢复到电解前的浓度,则电解过程中转移的电子数为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2﹣二溴乙烷在常温下是无色液体,密度是2.18g/cm3,沸点是131.4℃,熔点是9.79℃,不溶于水,易溶于醇、丙酮等有机溶剂.在实验室中可以用如图所示装置来制备1,2﹣二溴乙烷.其中试管c中装有液溴(表面覆盖少量水).

(1)写出制备1,2﹣二溴乙烷的化学方程式 .
(2)安全瓶a可以防止倒吸,并可以检查实验进行时试管c中导管是否发生堵塞.如果发生堵塞,a中的现象是 .
(3)容器b中NaOH溶液的作用是 ,容器d中NaOH溶液的作用是 .
(4)试管c浸入冷水中,以及液溴表面覆盖少量水的原因是 .
(5)某同学在做实验时,使用一定量的液溴,当溴全部褪色时,通入的乙烯混合气体的量比正常情况下超出许多.如果装置的气密性没有问题,试分析可能的原因 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com