
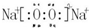 ;
;分析 一般来说,活泼金属和活泼非金属元素之间易形成离子键,不同非金属元素之间易形成极性共价键,同种非金属元素之间易形成非极性共价键,以此解答该题.
解答 解:(1)只存在共价键为共价化合物或非金属单质,二氧化碳符合,MgCl2为离子化合物,只存在离子键,而Ar为单原子分子,不存在共价键,
故答案为:②; ⑥; ①;
(2)Na2O2为离子化合物,电子式为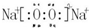 ,故答案为:
,故答案为: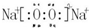 ;
;
(3)KOH为离子化合物,含有离子键和共价键,溶于水破坏离子键,氯化铵为离子化合物,加热分解破坏离子键和共价键,故答案为:离子键;离子键,共价键.
点评 本题考查了化学键的判断和电子式的书写,为高频考点,明确共价键和离子键的区别及电子式书写规则即可解答,题目难度不大.


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.009 mol/(L•s) | B. | 0.006mol/(L•s) | C. | 0.045mol/(L•s) | D. | 0.003mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 异戊二烯( )与等物质的量的Br2发生加成反应 )与等物质的量的Br2发生加成反应 | |
| B. | 2-氯丙烷( )与NaOH乙醇溶液共热发生消去HCl分子的反应 )与NaOH乙醇溶液共热发生消去HCl分子的反应 | |
| C. | 丙烷与氯气在光照的条件下发生取代反应生成一氯代物的反应 | |
| D. | 甲苯在一定条件下发生硝化生成一硝基甲苯的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

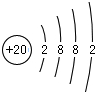 ,写出气体甲的电子式
,写出气体甲的电子式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为探究FeCl2溶液电解时阴阳极的产物,某兴趣小组用如下装置进行实验:(查阅资料:电解能否发生、电极反应及其速率,与电压大小、离子浓度等因素有关.)
为探究FeCl2溶液电解时阴阳极的产物,某兴趣小组用如下装置进行实验:(查阅资料:电解能否发生、电极反应及其速率,与电压大小、离子浓度等因素有关.)| 操作 | 现象和结论 |
| ①取一定量2mol/LNaCl溶液,调节溶液pH为4.91;再以相同装置进行电解. ②电解相同时间后,若电极b表面无气泡,取少量阳极附近的溶液, 滴入淀粉KI溶液. | 若溶液不变蓝,证明猜想①不成立 若溶液变蓝,证明猜想①可能成立. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 NH4Cl溶液:c(NH4+)<c( Cl-) | |
| B. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | 0.1 mol•L-1 Na2CO3溶液:c(Na+)=2c(HCO3-)+2c(CO32-)+2c(H2CO3) | |
| D. | NaHCO3溶液中:c(H+)+c(Na+)=c(OH-)+2c(CO32-)+c(HCO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com