
【题目】下列对分子性质的解释中,不正确的是( )
A.碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释
B.NF3和BF3的杂化方式不同,前者是sp2后者是sp3
C.HCHO、CH3—、SO3的分子空间构型相同
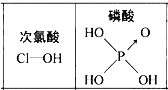
D.由图可知酸性:H3PO4>HClO,因为H3PO4分子中有1个非羟基氧原子
【答案】BC
【解析】
A. 四氯化碳、碘、甲烷都是非极性分子,水是极性分子,所以根据相似相溶原理可知,碘易溶于四氯化碳,甲烷难溶于水,A正确;
B. NF3中N原子孤电子对为![]() ,价层电子对为3+1=4,杂化方式是sp3,BF3中B原子孤电子对为
,价层电子对为3+1=4,杂化方式是sp3,BF3中B原子孤电子对为![]() ,价层电子对为3+0=3,杂化方式是sp2,B错误;
,价层电子对为3+0=3,杂化方式是sp2,B错误;
C. HCHO中C原子孤电子对为![]() ,价层电子对为3+0=3,VSEPR模型为平面三角形,分子空间构型为平面三角形,CH3—中C原子孤电子对为
,价层电子对为3+0=3,VSEPR模型为平面三角形,分子空间构型为平面三角形,CH3—中C原子孤电子对为![]() ,价层电子对为3+1=4,VSEPR模型为四面体型,离子空间构型为三角锥型,SO3中S原子孤电子对为
,价层电子对为3+1=4,VSEPR模型为四面体型,离子空间构型为三角锥型,SO3中S原子孤电子对为![]() ,价层电子对为3+0=3,VSEPR模型为平面三角形,分子空间构型为平面三角形,所以分子空间构型不完全相同,C错误;
,价层电子对为3+0=3,VSEPR模型为平面三角形,分子空间构型为平面三角形,所以分子空间构型不完全相同,C错误;
D. 含氧酸的酸性比较:非羟基氧原子数越多酸性越强,由图可知H3PO4分子中有1个非羟基氧原子,HClO分子中没有非羟基氧原子,所以酸性:H3PO4>HClO,D正确。
答案选BC。


科目:高中化学 来源: 题型:
【题目】钛由于其稳定的化学性质,良好的耐高温、耐低温、抗强酸、抗强碱以及高强度、低密度等特性,被美誉为“未来钢铁”“战略金属”。
![]() 基态钛原子核外电子有________种不同的空间运动状态,基态钛原子简化的电子排布式为________,区分晶态
基态钛原子核外电子有________种不同的空间运动状态,基态钛原子简化的电子排布式为________,区分晶态![]() 和非晶态
和非晶态![]() 最可靠的科学方法是对固体进行________。
最可靠的科学方法是对固体进行________。
![]() 钙钛矿
钙钛矿![]() 可应用于发光二极管。与钙元素同周期且最外层电子数相同的元素有种,氧元素可以与氯元素形成化合物
可应用于发光二极管。与钙元素同周期且最外层电子数相同的元素有种,氧元素可以与氯元素形成化合物![]() ,其中氧原子的杂化方式为________,
,其中氧原子的杂化方式为________,![]() 的空间构型为________。
的空间构型为________。
![]() 在浓的
在浓的![]() 的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为
的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为![]() 的绿色晶体,该晶体中两种配体的物质的量之比为
的绿色晶体,该晶体中两种配体的物质的量之比为![]() ,则该配离子的化学式为________。
,则该配离子的化学式为________。
![]() 钛在较高温度下可与氧或氮元素及其化合物发生反应,O、N元素形成的简单氢化物的键角前者小于后者的原因是________。
钛在较高温度下可与氧或氮元素及其化合物发生反应,O、N元素形成的简单氢化物的键角前者小于后者的原因是________。
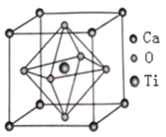
![]() 钛酸钙的晶胞结构如图所示,晶胞中两个最近的氧原子之间的距离为apm,晶胞中钛的氧配位数为________,晶胞的密度为________
钛酸钙的晶胞结构如图所示,晶胞中两个最近的氧原子之间的距离为apm,晶胞中钛的氧配位数为________,晶胞的密度为________![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】姜黄素是一种天然染料,工业上可用石油的裂解产物通过如图反应制得:
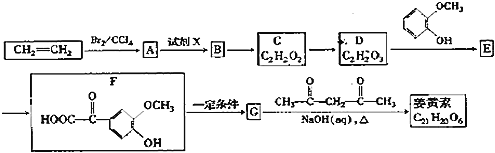
已知:![]()
![]() CH3CHO+
CH3CHO+![]()
![]()
![]() +H2O
+H2O
请回答下列问题:
![]() 试剂X为 ______ ;
试剂X为 ______ ;
![]() 最多能消耗Na、NaOH、
最多能消耗Na、NaOH、![]() 的物质的量分别为3mo1、2mol、1mol,则E的结构简式为 ______ ;
的物质的量分别为3mo1、2mol、1mol,则E的结构简式为 ______ ;
![]() 姜黄素中的含氧官能团除甲氧基
姜黄素中的含氧官能团除甲氧基![]() 外还有 ______
外还有 ______ ![]() 写名称
写名称![]() ;
;
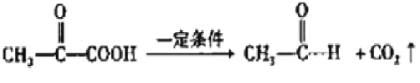
![]() 反应
反应![]() 的化学方程式为 ______ ,其反应类型是 ______ ;
的化学方程式为 ______ ,其反应类型是 ______ ;
![]() 符合下列条件G的同分异构体共有 ______ 种,其中核磁共振氢谱中有5组峰,且面积比为2:2:2:1:1的是 ______ ;
符合下列条件G的同分异构体共有 ______ 种,其中核磁共振氢谱中有5组峰,且面积比为2:2:2:1:1的是 ______ ;
①属于芳香酯类 ②苯环上有两个取代基 ③能与![]() 溶液发生显色反应
溶液发生显色反应
![]() 借鉴制取姜黄素的方法也能合成肉桂醛(
借鉴制取姜黄素的方法也能合成肉桂醛(![]() ),写出制备肉桂醛所需有机物的结构简式 ______ 。
),写出制备肉桂醛所需有机物的结构简式 ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无色而有刺激性气味的甲酸,是最简单的羧酸液体,熔点8.6℃,沸点100.8℃。化学实验室常用甲酸(HCOOH)和浓硫酸混合加热制备一氧化碳,其反应方程式为:HCOOH![]() CO↑+H2O,制备时先加热浓硫酸至80℃-90℃,控制温度,再逐滴滴入甲酸。
CO↑+H2O,制备时先加热浓硫酸至80℃-90℃,控制温度,再逐滴滴入甲酸。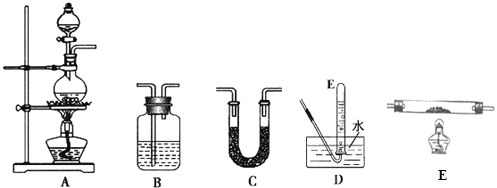
(1)请从图中选用所需的仪器(仪器可重复使用)组成一套验证甲酸(HCOOH)和浓硫酸加热生成产物的实验装置。现提供以下药品:甲酸、浓硫酸、无水硫酸铜、氧化铜粉末、澄清石灰水。将所用仪器的序号按连接顺序由上至下依次填入下表(可以不填满),并写出该仪器中应加试剂的名称或化学式(划横线部分不需要填写)。___
选用的仪器 | 加入的试剂 |
A | 甲酸、浓硫酸 |
D | -- |
证明有一氧化碳生成的现象是___。
(2)实验室可用甲酸制备甲酸铜。其方法是先用硫酸铜和碳酸氢钠作用制得碱式碳酸铜,然后再与甲酸制得四水甲酸铜[Cu(HCOO)24H2O]晶体。查阅资料可知四水甲酸铜晶体为浅蓝色晶体,可溶于水,难溶于醇。
相关的化学方程式是:2CuSO4+4NaHCO3=Cu(OH)2CuCO3↓+3CO2↑+2Na2SO4+H2O;Cu(OH)2CuCO3+4HCOOH+5H2O=2Cu(HCOO)24H2O+CO2↑
实验步骤如下:
Ⅰ.碱式碳酸铜的制备:
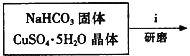
![]()
![]()
①步骤ⅰ是将一定量CuSO45H2O晶体和NaHCO3固体一起放到研钵中研磨,其目的是___。
②步骤ⅱ是在搅拌下将固体混合物分多次缓慢加入热水中,反应温度控制在70℃-80℃,如果看到___(填写实验现象),说明温度过高。
Ⅱ.甲酸铜的制备:将Cu(OH)2CuCO3固体放入烧杯中,加入一定量热的蒸馏水,再逐滴加入甲酸至碱式碳酸铜恰好全部溶解,趁热过滤除去少量不溶性杂质。在通风橱中蒸发滤液至原体积的![]() 时,冷却析出晶体,过滤,再用少量无水乙醇洗涤晶体2-3次,晾干,得到产品。
时,冷却析出晶体,过滤,再用少量无水乙醇洗涤晶体2-3次,晾干,得到产品。
③制取甲酸铜时需要趁热过滤的原因是___。
④用无水乙醇洗涤晶体的目的是___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、D、E的原子序数依次增大,B、E位于同主族,四种元素组成的一种化合物M的结构式为![]() 。下列说法不正确的是
。下列说法不正确的是
A.E的最简单氢化物的还原性比B的弱B.D与E形成的二元化合物的水溶液显碱性
C.B与E形成的化合物不都是极性分子D.A与D形成的二元化合物中含有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)被人们称为“绿色化学”净水剂,它在强碱性溶液中稳定,在Fe(OH)3催化作用下会发生分解。以硫铁矿烧渣(主要成分Fe2O3、SiO2,少量的Fe3O4、Al2O3、MgO)生产K2FeO4的工艺流程如下:
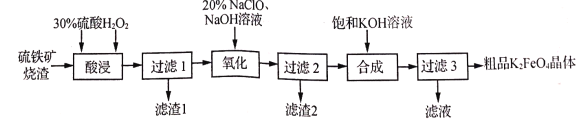
(l)滤渣1的主要成分是_______(填化学式)。
(2)“酸浸”中,氧化铁与硫酸反应的化学方程式_____。添加适量的H2O2的作用是将_______,加入硫酸的量不宜过量太多的原因是_______。
(3)“氧化”时,在碱性环境下加入适量NaClO,则发生反应离子方程式为______,滤渣2的成分为___(填化学式)。
(4)“过滤3”所得滤液中含有的阴离子有OH一、Cl一、SO42-、_____、_____(填化学式)。
(5)电解法也可制得K2FeO4,装置如右图所示。阳极的电板及应式为_______。
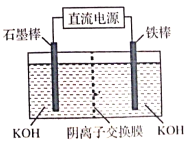
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联合国大会宣布2019年是“国际化学元素周期表年”(I YPT 2019)·下列运用元素周期律分析的推断中,错误的是
A.铍(Be)的氧化物的水化物具有两性
B.砹(At)为有色固体,AgAt感光性很强,不溶于水
C.硫酸锶(SrSO4)是难溶于水的白色固体
D.硒化氢(H2Se)是无色、有毒,比H2S稳定的气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备溴苯的反应装置如下图所示,关于实验操作或叙述错误的是

A. 向圆底烧瓶中滴加苯和溴的混合液前需先打开K
B. 实验中装置b中的液体逐渐变为浅红色
C. 装置c中的碳酸钠溶液的作用是吸收溴化氢
D. 反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组欲测定KClO3溶液与NaHSO3溶液反应的化学反应速率。所用试剂为![]() 溶液和
溶液和![]() 溶液,所得数据如图所示。已知:
溶液,所得数据如图所示。已知:![]() 。
。
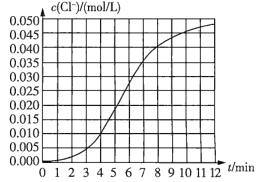
(1)根据实验数据可知,该反应在0~4min内的平均反应速率![]() _______
_______![]() 。
。
(2)某同学仔细分析实验数据后发现,在反应过程中,该反应的化学反应速率先增大后减小。某小组同学针对这一现象进一步探究影响该化学反应速率的因素,具体方法如表所示。
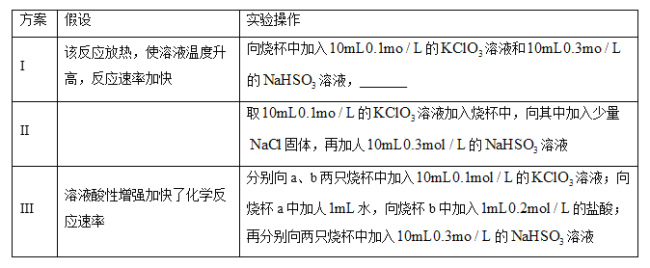
①补全方案I中的实验操作:_______。
②方案II中的假设为_______。
③除I、II、III中的假设外,还可以提出的假设是_______。
④某同学从控制变量的角度思考,认为方案III中实验操作设计不严谨,请进行改进:_______。
⑤反应后期,化学反应速率变慢的原因是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com