
【题目】为研究 NH3的某种性质并测定其组成,某小组课外活动欲利用 CuO 与 NH3 反应,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:
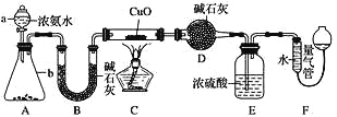
(1)仪器 D 的名称为 _____________。
(2)实验中观察到装置 C 中黑色 CuO 粉末变为红色固体,量气管有无色无味的气体,上述现象证明 NH3 具有 _____________性,写出相应的化学方程式 ____________。
(3)E 装置中浓硫酸的作用 ____________。
(4)读取气体体积前,应对装置 F 进行的操作:_____________。
(5)实验完毕,若测得干燥管 D 增重 mg,装置 F 测得气体的体积为 n L(已折算成标准状况),则氨分子中氮、氢的原子个数比为____________(用含 m、n 字母的代数式表示)
(6)在实验室中用图中 A 装置也可制取 SO2 气体:
①选用的药品可以是 _____________。
A.Na2SO3 溶液与 HNO3 B.铜与浓 H2SO4
C.碳与浓 H2SO4 D.Na2SO3 固体与浓 H2SO4
②将制得的 SO2通入淀粉碘化钾溶液,现象为 _______________________,表明 SO2 的氧化性比 I2________(填“强或“弱”)。
③实验室用 NaOH 溶液作为 SO2 的吸收剂防止污染空气,若向 100mL 0.3mol/L 的 NaOH溶液中通入标准状况下 0.448LSO2 气体,所得溶液中的溶质是_________(填化学式)。
【答案】球形干燥管 还原 2NH3 + 3CuO ![]() 3Cu + N2 + 3H2O 防止F中的水分进入D装置,并吸收未反应的氨气 调整F装置,使两边液面相平
3Cu + N2 + 3H2O 防止F中的水分进入D装置,并吸收未反应的氨气 调整F装置,使两边液面相平 ![]() D 无明显现象或溶液不变蓝 弱 Na2SO3和NaHSO3
D 无明显现象或溶液不变蓝 弱 Na2SO3和NaHSO3
【解析】
实验室一般用浓氨水和氧化钙反应生成氨气,用碱石灰干燥氨气,再通入到氧化铜中生成铜、氮气和水,用碱石灰干燥,再用浓硫酸吸收未反应的氨气,用量气管测定生成的氮气的体积时,使用量气管读数之前要冷却至室温,将两端液面相平。
(1)仪器D的名称为球形干燥管;故答案为:球形干燥管。
(2)实验中观察到装置 C 中黑色 CuO 粉末变为红色固体,量气管有无色无味的气体,说明氧化铜变为铜,化合价降低,氨气反应生成氮气,化合价升高,因此上述现象证明NH3 具有还原性,相应的化学方程式2NH3 + 3CuO![]() 3Cu + N2 + 3H2O;故答案为:还原;2NH3 + 3CuO
3Cu + N2 + 3H2O;故答案为:还原;2NH3 + 3CuO![]() 3Cu + N2 + 3H2O。
3Cu + N2 + 3H2O。
(3)C装置中氨气与氧化铜反应,部分未反应完的氨气进入到后续装置,因此E装置中浓硫酸的作用防止F中的水分进入D装置,并吸收未反应的氨气;故答案为:防止F中的水分进入D装置,并吸收未反应的氨气。
(4)读取气体体积前,装置两端的液面应该相平,因此应对装置F进行的操作:调整F装置,使两边液面相平;故答案为:调整F装置,使两边液面相平。
(5)实验完毕,若测得干燥管 D增重mg即为水的质量,物质的量为![]() ,装置F测得气体的体积为nL(已折算成标准状况),则氮气的物质的量
,装置F测得气体的体积为nL(已折算成标准状况),则氮气的物质的量![]() ,根据元素守恒,则氨分子中氮、氢的原子个数比为
,根据元素守恒,则氨分子中氮、氢的原子个数比为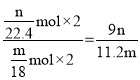 ;故答案为:
;故答案为:![]() 。
。
(6)①A.Na2SO3 溶液与 HNO3发生氧化还原反应,不会生成SO2 气体,故A不符合题意;
B.铜与浓 H2SO4在加热条件下才发生反应,故B不符合题意;
C.碳与浓 H2SO4加热才反应,故C不符合题意;
D.Na2SO3 固体与浓H2SO4反应生成SO2 气体,故D符合题意;
综上所述,答案为D。
②SO2与碘化钾溶液不反应,因此SO2通入淀粉碘化钾溶液,现象为无明显现象,说明SO2与碘化钾溶液不能生成I2,表明 SO2 的氧化性比 I2弱;故答案为:无明显现象或溶液不变蓝;弱。
③实验室用 NaOH 溶液作为 SO2 的吸收剂防止污染空气,若向 100mL 0.3 molL1的 NaOH溶液物质的量为0.3 molL1×0.1L =0.03mol,通入标准状况下0.448LSO2 气体即物质的量为![]() ,根据SO2+2NaOH=Na2SO3+H2O,SO2+NaOH = NaHSO3分析,由于
,根据SO2+2NaOH=Na2SO3+H2O,SO2+NaOH = NaHSO3分析,由于![]() ,说明所得溶液中的溶质两者都有,即化学式为Na2SO3和NaHSO3;故答案为:Na2SO3和NaHSO3。
,说明所得溶液中的溶质两者都有,即化学式为Na2SO3和NaHSO3;故答案为:Na2SO3和NaHSO3。


科目:高中化学 来源: 题型:
【题目】将1.92 g铜跟适量的浓硝酸反应,铜全部作用后,共收集到1.12 L标准状况下的气体(假设只有NO2、NO),则反应消耗的硝酸的物质的量可能是
A.0.11 molB.0.1 molC.0.09 molD.0.08 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合肼(N2H4·H2O)又名水合联氨,是无色透明、具有腐蚀性和强还原性的碱性液体,它是一种重要的化工试剂,利用尿素法生产水合肼的原理为CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCl。
实验一:制备NaClO溶液。(实验装置如图1所示)

(1)下列仪器在配制100 mL7.5mol/L的NaOH溶液时,可能用到的有_______(填字母)。
A.容量瓶 B.烧瓶 C.胶头滴管 D.玻璃棒
(2)锥形瓶中发生反应的离子方程式为____。
实验二:制取水合肼。(实验装置如图2所示)
(3)①装置A的名称为____,反应过程中需控制反应温度,同时将分液漏斗中溶液缓慢滴入A中,如果滴速过快则会导致产品产率降低,同时产生大量氮气,写出该过程的化学反应方程式:____________,故分液漏斗中的溶液是_____(填字母)。
A. CO(NH2)2溶液 B. NaOH和NaClO
②充分反应后,加热A内的溶液,收集108~114℃的馏分,即可得到水合肼的粗产品。
实验三:测定馏分中肼含量。
(4)称取馏分5.0 g,加入适量NaHCO3固体,加水配成250 mL溶液,移岀25.00 mL置于锥形瓶中,并滴加23滴淀粉溶液,用0.10 mol/L的标准I2溶液滴定。滴定过程中,溶液的pH保持在6.5左右。(已知:N2H4·H2O + 2I2=N2↑+ H2O+4HI)
滴定时,碘的标准溶液盛放在____(填“酸式”或“碱式”)滴定管中;本实验滴定终点的现象为____。实验测得消耗I2溶液的平均值为18.00 mL,馏分中水合肼(N2H4·H2O)的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是广泛用于橡胶工业的硫化剂,常温下
是广泛用于橡胶工业的硫化剂,常温下![]() 是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体,其结构与
是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体,其结构与![]() 类似
类似![]() 下列说法错误的是
下列说法错误的是![]()
A. ![]() 分子中的两个S原子均是
分子中的两个S原子均是![]() 杂化
杂化
B. ![]() 与
与![]() 反应的化学方程式可能为:
反应的化学方程式可能为:![]()
C. ![]() 与
与![]() 结构相似,熔沸点
结构相似,熔沸点![]()
D. ![]() 分子中的S为
分子中的S为![]() 价,是含有极性键和非极性键的非极性分子
价,是含有极性键和非极性键的非极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pKa=-lgKa。25℃时,H2A的pKa1=1.85,pKa2=7.19。常温下,用0.1 mol·L-1 NaOH溶液滴定20mL0.1mol·L-1H2A溶液的滴定曲线如图所示。下列说法不正确的是

A. a点溶液中:c(HA-)=c(H2A)
B. b点溶液中:A2-水解平衡常数Kh1=10-6.81
C. c点溶液中:V0=30
D. a、b、c、d四点中,d点溶液中水的电离程度最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把少量废铁屑溶于过量稀硝酸中,过滤,除去杂质,在滤液中加入过量的氨水,有沉淀生成。过滤,加热沉淀物至质量不再变化,得到红棕色的残渣。上述沉淀和残渣分别为 ()
A.Fe(OH)3;Fe2O3B.Fe(OH)2 ;FeOC.Fe(OH)3 ;Fe(OH)2 ;Fe3O4D.Fe2O3;Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有Al、CuO、Fe2O3组成的混合物共10.0 g,放入500 mL某浓度的盐酸溶液中,混合物完全溶解,当再加入250 mL 2.0 mol/L的NaOH溶液时,得到的沉淀最多。上述盐酸溶液的浓度为( )
A.0.5 mol/LB.1.0 mol/LC.2.0 mol/LD.3.0 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CsF是离子晶体,其晶格能可通过下图的循环计算得到,以下说法错误的是
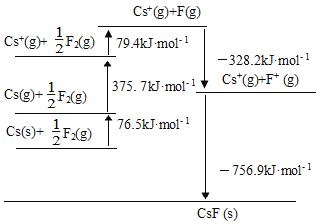
A. Cs原子的第一电离能为452.2 kJ·mol1
B. F-F键的键能为158.8 kJ·mol1
C. CsF的晶格能756.9kJ·mol1
D. 1molCs(s)转变成Cs(g)所要吸收的能量为76.5kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气中氮氧化物和碳氢化合物受紫外线作用可产生一次污染物——光化学烟雾,其中部分物质的反应过程如图所示。下列说法正确的是( )

A.该过程中![]() 作催化剂B.反应过程中没有电子转移
作催化剂B.反应过程中没有电子转移
C.反应过程中氮氧化物不断被消耗D.丙烯转化为甲醛和乙醛
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com