
【题目】某温度时,在一个容积为2L 的密闭容器中,X、Y、Z物质的物质的量随时间的变化曲线如图。所示根据图中数据,试填写下列空白:

(1)该反应的化学方程式为______;
(2)反应开始至2min,气体Z的平均反应速率为______;
(3)若X、Y、Z均为气体,则反应起始时与平衡后的压强之比是________;
(4)以下说法能列定该反应已达平衡状态的是________
A.X、Y、Z的浓度之比是1:2:3
B.X的消耗速率和Y的生成速率相等
C.Z的浓度保持不变
D.单位时间内生成0.03molZ的同时生成0.02mol的Y
【答案】 3X+2Y3Z 0.125mol/(L.min) 4:3 BCD
【解析】(1)由图象可以看出,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,且反应物没有完全转化,是可逆反应;则△n(X):△n(Y):△n(Z)=0.75mol∶0.5mol∶0.75mol=3∶2∶3,则反应的化学方程式为:3X+2Y ![]() 2Z;
2Z;
(2)反应开始至2min,气体Z的平均反应速率为 =0.125mol/(L·min);
=0.125mol/(L·min);
(3)根据阿伏加德罗定律可知,恒容恒温条件下,压强与气体的物质的量成正比,若X、Y、Z均为气体,则反应起始时与平衡后的压强之比是2mol∶(0.25+0.5+0.75)mol=4:3;
(4)A.X、Y、Z的浓度之比是1:2:3时,反应不一定是平衡状态,故A错误;B.X的消耗速率和Y的生成速率相等,即正逆反应速率相等,是平衡状态,故B正确;C.Z的浓度保持不变,量一定是平衡状态,故C正确;D.单位时间内生成0.03molZ的同时生成0.02mol的Y,正逆反应速率相等,是平衡状态,故D正确;答案为BCD。


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】下列变化中,既有共价键和离子键断裂,又有共价键和离子键形成的是( )
A.2Na+2H2O=2NaOH+H2↑
B.2Na2O2+2CO2=2Na2CO3+O2
C.Cl2+H2OHCl+HC1O
D.Na2CO3+BaCl2=BaCO3↓+2NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙两位同学,他们一起做了如图所示的水果电池实验,测得数据如下表:
实验次数 | 电极材料 | 水果品种 | 电极间距/cm | 电压/mV | |
1 | 锌 | 铜 | 菠萝 | 3 | 900 |
2 | 锌 | 铜 | 苹果 | 3 | 650 |
3 | 锌 | 铜 | 柑橘 | 3 | 850 |
4 | 锌 | 铜 | 西红柿 | 3 | 750 |
5 | 锌 | 铝 | 菠萝 | 3 | 650 |
6 | 锌 | 铝 | 苹果 | 3 | 450 |
甲同学提出的问题,乙同学解释不正确的是
①甲:实验6中的负极反应如何写? 乙:铝为负极:Al-3e-===Al3+
②甲:实验1、5电流方向为什么相反? 乙:实验1中锌为负极,电流由铜经导线流向锌;实验5中铝为负极,铝失去电子,电流由锌经导线流向铝
③甲:水果电池的电压与哪些因素有关? 乙:只跟水果的品种有关。
A. ③ B. ① C. ①②③ D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,在25 mL 0.1 mol·L-1的NaOH溶液中逐渐加入0.2 mol·L-1 CH3COOH溶液,混合溶液pH的变化曲线如图所示,下列分析结论正确的是( )
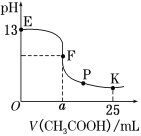
A.a=12.5,且混合溶液pH=7
B.对应曲线上E、F之间的任何一点,溶液中都有 c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
C.K点时,c(CH3COO-)+c(CH3COOH)=2c(Na+)
D.P点时,c(CH3COO-)>c(Na+)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 无水CaCl2可用于干燥H2、Cl2和NH3
B. 无水硫酸铜与胆矾的相互转化属于化学变化
C. 代替传统火药鞭炮的“电子鞭炮”无任何的污染问题
D. 制造光导纤维的主要材料为晶体硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.1 mol·L-1的某一元酸(HA)溶液中![]() =1×10-8,下列叙述正确的是
=1×10-8,下列叙述正确的是
A.该一元酸溶液的pH=1
B.该溶液中水电离出的c(H+)=1×10-11molL-1
C.该溶液中水的离子积常数为1×1022
D.用 pH=11的NaOH 溶液 V1 L 与V2 L 0.1 mol·L-1该一元酸(HA)溶液混合,若混合溶液的pH=7,则V1<V2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在透明溶液中,不能大量共存的离子组是( )AC
A.Cu2+、Na+、SO42-、Cl- B.K+、Na+、HCO3-、NO3-
C.OH-、HCO3-、Ca2+、Na+ D.Ba2+、Na+、OH-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—定温度下,在三个容积均为2.0 L的恒容密闭容器中发生反应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)各容器中起始物质的量浓度与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随间变化关系如下图所示。
N2(g)+2CO2(g)各容器中起始物质的量浓度与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随间变化关系如下图所示。
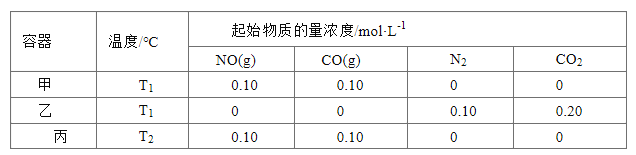
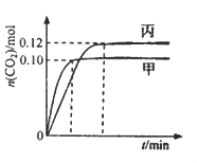
下列说法正确的是
A. 该反应的正反应为吸热反应
B. 乙容器中反应达到平衡时,N2的转化率小于50%
C. 达到平衡时,乙容器中的压强一定大于甲容器的2倍
D. 丙容器中反应达到平衡后,再充入0.10mol NO和0.10mol CO2,此时v(正)<v(逆)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com