
| A. | ① | B. | ②③ | C. | ②④ | D. | ③④ |
分析 常温下,0.1mol•L-1某一元酸(HA)溶液pH=3,氢离子浓度小于酸浓度,说明HA部分电离,所以是弱酸;
①常温下,C(H+)(水)=C(OH-)=$\frac{1{0}^{-14}}{1{0}^{-3}}$mol/L=10-11mol•L-1;
②HA是弱电解质,在水溶液中部分电离,HCl是强电解质,在水溶液中完全电离,pH=3的HA浓度大于pH=4盐酸的10倍,二者分别与NaOH按物质的量以1:1进行反应;
③任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
④任何电解质溶液中都存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断.
解答 解:常温下,0.1mol•L-1某一元酸(HA)溶液pH=3,氢离子浓度小于酸浓度,说明HA部分电离,所以是弱酸;
①常温下,C(H+)(水)=C(OH-)=$\frac{1{0}^{-14}}{1{0}^{-3}}$mol/L=10-11mol•L-1,故错误;
②HA是弱电解质,在水溶液中部分电离,HCl是强电解质,在水溶液中完全电离,pH=3的HA浓度大于pH=4盐酸的10倍,二者分别与NaOH按物质的量以1:1进行反应,消耗NaOH的物质的量相等,则两种酸的物质的量相等,pH=3的HA浓度大于pH=4盐酸的10倍,则消耗酸溶液体积10V1小于V2,故正确;
③任何电解质溶液中都存在电荷守恒,根据电荷守恒得C(H+)+c(Na+)=c(A-)+c(HA),所以c(Na+)<c(A-)+c(HA),故错误;
④0.1mol•L-1HA溶液与0.05mol•L-1NaOH溶液等体积混合后所得溶液为NaA和HA等浓度的混合液. 物料守恒得C(HA)+C(A-)=2C(Na+)、电荷守恒得:C(A-)+C(OH-)=C(H+)+C(Na+),所以得出2c(H+)+c(HA)═c(A-)+2c(OH-),故正确;
故选C.
点评 本题以弱电解质的电离为载体考查离子浓度大小比较,正确判断HA的强弱是解本题关键,注意:任何电解质溶液中都存在电荷守恒和物料守恒,与溶液酸碱性及浓度大小无关,题目难度不大.


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 丙烷跟甲烷一样能与氯气发生取代反应 | |
| B. | 1 mol乙酸与乙醇在一定条件下发生酯化反应,可生成1 mol乙酸乙酯 | |
| C. | CH2Cl2是纯净物说明甲烷是四面体结构而不是正方形结构 | |
| D. | 溴水既可鉴别乙烷与乙烯,又可除去乙烷中的乙烯而得到纯净的乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | OF2 | B. | SO2 | C. | H3O+ | D. | NH${\;}_{4}^{+}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
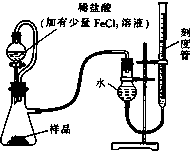 过氧化镁(MgO2)易溶于稀酸,溶于酸后产生过氧化氢,在医学上可作为解酸剂等.过氧化镁产品中常会混有少量MgO,实验室可通过多种方案测定样品中过氧化镁的含量.
过氧化镁(MgO2)易溶于稀酸,溶于酸后产生过氧化氢,在医学上可作为解酸剂等.过氧化镁产品中常会混有少量MgO,实验室可通过多种方案测定样品中过氧化镁的含量.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:A>B>C>D | B. | 原子序数:d>c>b>a | ||
| C. | 单质的还原性:A>B>D>C | D. | 离子半径:C>D>B>A |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化三碳的电子式为 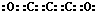 | B. | C3O2、CO、CO2都是碳的氧化物 | ||
| C. | C3O2和CO2中原子不全为sp杂化 | D. | C3O2不是碳酸的酸酐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
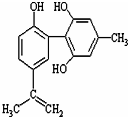 体育竞技中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示.有关该物质的说法中正确的是( )
体育竞技中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示.有关该物质的说法中正确的是( )| A. | 该物质的分子式为C16H15O3 | |
| B. | 该物质与苯酚属于同系物,遇FeCl3溶液呈紫色 | |
| C. | 该分子中的所有碳原子不可能共平面 | |
| D. | 1mol此物质分别与浓溴水和H2反应时最多消耗Br2和H2为4mol 和7mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯用带橡胶塞的试剂瓶贮存 | B. | 浓硝酸存放在棕色试剂瓶中 | ||
| C. | 少量白磷存放在水中 | D. | 少量金属钠存放在煤油中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
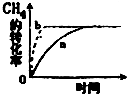 碳及其化合物在人类生产、生活中的应用非常广泛.“低碳生活”不再只是一种理想,更是一种值得期待的生活方式.
碳及其化合物在人类生产、生活中的应用非常广泛.“低碳生活”不再只是一种理想,更是一种值得期待的生活方式.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com