
①把蒸馏水煮沸,以赶走其中溶解的O2 ②溶解时加入少量盐酸,以防Fe2+水解 ③加入少量还原铁粉,以防Fe2+被氧化 ④溶解时加入少量稀H2SO4,以防Fe2+水解
A.①②③ B.①③④ C.①②③④ D.③④
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源:2011-2012学年广东省三校高二下学期联考化学试卷(带解析) 题型:填空题
(14分)FeCl3在选修四中出现的次数较多,可见其重要性.
(1)在演示催化剂对化学反应速率的影响实验中,向H2O2溶液中分别滴入FeCl3溶液和CuSO4溶液,催化效果更好的是________ (1分),画出无催化剂和有催化剂的能量-反应进程对比图,并作必要的文字注明(3分)
(2)在演示增加反应物浓度对化学平衡的影响实验中,稀FeCl3溶液与稀KSCN溶液混合,溶液呈较浅血红色。将该浅血红色分成两等份,分别加入同浓度的FeCl3溶液和稀KSCN溶液,红色变得更深的是________(1分), 从化学平衡常数的角度加以分析(3分)(温度不变,假设后加入的FeCl3溶液和稀KSCN溶液都是各自起始浓度的10倍)(3分)
(3)分别取若干毫升稀FeCl3溶液与稀KSCN溶液混合,溶液呈较浅血红色。限用FeCl3、KSCN、 KCl三种化学药品,为证明FeCl3溶液与KSCN溶液的反应是一个可逆反应,至少还要进行( )次实验。
| A.1 | B.2 | C.3 | D.4 |
查看答案和解析>>
科目:高中化学 来源:2014届江苏省泰州市姜堰区高三上学期期中考试化学试卷(解析版) 题型:实验题
(1)下列实验操作或对实验事实的描述不正确的有 (填序号)。
A.用托盘天平称量17.55g氯化钠晶体
B.碳酸钠溶液保存在带玻璃塞的试剂瓶
C.用干燥的pH试纸测定新制氯水的pH
D.使用容量瓶配制溶液时,俯视刻度线定容后浓度偏大
E.向饱和FeCl3溶液中滴加少量NaOH溶液,可制取Fe(OH)3胶体
F.除去CO2气体中混有的少量HCl,可以将气体通入饱和碳酸氢钠溶液
(2)下图为中学化学实验中常见的实验装置
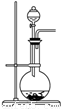
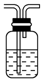

A B C
实验室常用装置A制备下表中气体,请将分液漏斗和圆底烧瓶中应装的化学试剂填写完整。
|
气体 |
O2 |
Cl2 |
NH3 |
|
分液漏斗中试剂 |
|
|
浓氨水 |
|
圆底烧瓶中试剂 |
|
KMnO4 |
|
可用B装置排液收集气体,气体应从该装置________(填“左”“右”)管口导进,倘若利用该装置收集Cl2,试剂瓶中盛放的试剂为 。
C装置用于处理多余气体对环境的污染,若利用该装置吸收Cl2,此时烧杯中发生反应的离子方程式为 。倘若该装置中仅仅盛放稀硫酸,通常不适合吸收氨气的原因是 ,若向烧杯中额外再加入一种液态有机物则可安全吸收氨气,这种有机物为 。
查看答案和解析>>
科目:高中化学 来源:2013届广东省三校高二下学期联考化学试卷(解析版) 题型:填空题
(14分)FeCl3在选修四中出现的次数较多,可见其重要性.
(1)在演示催化剂对化学反应速率的影响实验中,向H2O2 溶液中分别滴入FeCl3溶液和CuSO4溶液,催化效果更好的是________ (1分),画出无催化剂和有催化剂的能量-反应进程对比图,并作必要的文字注明(3分)
(2)在演示增加反应物浓度对化学平衡的影响实验中,稀FeCl3溶液与稀KSCN溶液混合,溶液呈较浅血红色。将该浅血红色分成两等份,分别加入同浓度的FeCl3溶液和稀KSCN溶液,红色变得更深的是________(1分), 从化学平衡常数的角度加以分析(3分)(温度不变,假设后加入的FeCl3溶液和稀KSCN溶液都是各自起始浓度的10倍)(3分)
(3)分别取若干毫升稀FeCl3溶液与稀KSCN溶液混合,溶液呈较浅血红色。限用FeCl3、KSCN、 KCl三种化学药品,为证明FeCl3溶液与KSCN溶液的反应是一个可逆反应,至少还要进行( )次实验。
A.1 B.2 C.3 D.4
(4)实验室配制和保存FeCl3溶液,要向其中加入________,防止其水解变质。
(5)0.1mol·L-1 FeCl3溶液中的c(Fe3+) 比0.1mol·L-1 (NH4)Fe(SO4)2溶液中的c(Fe3+)______.
查看答案和解析>>
科目:高中化学 来源:广东省期末题 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com