
| A. | H2和H3属于同位素 | B. | O2和O4属于同素异形体 | ||
| C. | C60晶体是原子晶体 | D. | N5+中含有36个电子 |
分析 A.质子数相同,中子数不同的原子互称同位素;
B.相同元素组成,不同形态的单质互为同素异形体;
C.C60的一个分子中含有60个碳原子;
D.阳离子中核外电子数=核内质子数-离子所带电荷数.
解答 解:A.因质子数相同,中子数不同的原子互称同位素,而H2和H3是由氢元素形成的不同单质,两者是同素异形体,故A错误;
B.O2和O4都是由氧元素形成的不同单质,故互为同素异形体,故B正确;
C.C60的一个分子中含有60个碳原子,相对分子质量为12×60=720,是分子晶体,故C错误;
D.N5+中的电子数为7×5-1=34,故D错误;
故选B.
点评 本题考查同位素、同素异形体、原子晶体的概念,电子数的计算等,题目难度不大.对于元素、核素、同位素、同素异形体、同分异构体、同系物、同种物质等概念的区别是考试的热点问题.


科目:高中化学 来源: 题型:解答题
 已知有H、C、N、O、Na、Si、Cl、Ca、Fe等元素,请回答下列问题:
已知有H、C、N、O、Na、Si、Cl、Ca、Fe等元素,请回答下列问题: (写出一种即可).
(写出一种即可).查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Cl-、Mg2+、H+、Zn2+、SO42- | B. | Na+、Ba2+、NO3-、OH-、SO42- | ||
| C. | K+、NO3-、SO42-、OH-、Na+ | D. | MnO4-、K+、Cl-、H+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钙溶液中通入CO2气体:Ca2++CO2+H2O=CaCO3+2H+ | |
| B. | 以石墨作电极电解氯化铝溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2+Cl2 | |
| C. | 200mL2mol/L的FeBr2溶液中通入11.2L标准状况下的氯气:4Fe2++6Br-+5Cl2=4Fe3++3Br2+10Cl- | |
| D. | 向明矾溶液中加人氢氧化钡溶液至沉淀的物质的量最大:Al3++2SO42-+4OH-=2BaSO4↓+AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
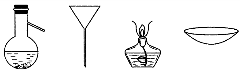
| A. | 蒸发、萃取、蒸馏、过滤 | B. | 蒸馏、过滤、蒸发、蒸发 | ||
| C. | 萃取、过滤、蒸馏、蒸发 | D. | 过滤、蒸发、萃取、蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32g O2所含的原子数目为2NA | |
| B. | 0.5NA个氯气分子的物质的量是0.5mol | |
| C. | 在标准状况下,22.4 L CH4与18 g H2O所含有电子数均为10NA | |
| D. | 22.4 L的CO气体与1 mol N2所含的电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体熔点由低到高:CF4<CCl4<CBr4<CI4 | |
| B. | 熔点由高到低:Na>Mg>Al | |
| C. | 沸点:水>碲化氢>硒化氢 | |
| D. | 晶格能由大到小:MgO>CaO>NaF>NaCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com