
两份铝屑,第一份与足量盐酸反应,第二份与足量NaOH溶液反应,产生的氢气的体积比为1:2(相同状况下),则第一份与第二份铝屑的质量比为( )
A.1:l B.1:2 C.1:3 D.2:1
考点:化学方程式的有关计算;铝的化学性质.
专题:计算题.
分析:铝与盐酸以及NaOH溶液反应的化学方程式分别为:2Al+6HCl=2AlCl3+3H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
盐酸以及NaOH溶液足量,则铝完全反应,根据反应的方程式计算.
解答: 解:盐酸与NaOH溶液足量,则铝完全反应,设铝与盐酸、NaOH溶液反应生成的氢气的物质的量分别为xmol、2xmol,
则2Al+6HCl=2AlCl3+3H2↑
2 3
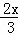 x
x
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2 3
 2x
2x
则第一份与第二份铝屑的质量比为:(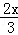 mol×27g/mol):(
mol×27g/mol):( mol×27g/mol)=1:2,
mol×27g/mol)=1:2,
故选B.
点评:本题考查化学方程式的计算,题目难度不大,解答本题的关键是要正确书写反应的有关方程式,注意题中盐酸和NaOH足量这一点.也可利用电子守恒来计算解答.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实.2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g) 下列叙述错误的是()
CH3CH2OH(g)+3H2O(g) 下列叙述错误的是()
 A. 使用Cu﹣Zn﹣Fe催化剂可大大提高生产效率
A. 使用Cu﹣Zn﹣Fe催化剂可大大提高生产效率
B. 反应需在300℃进行可推测该反应是吸热反应
C. 充入大量CO2气体可提高H2的转化率
D. 从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物CH2=CH﹣CH2﹣CH(OH)﹣COOH在不同条件下可能发生有机反应类型有:①加成;②取代;③消去;④氧化;⑤酯化;⑥加聚;⑦缩聚.其中因分子结构中含﹣OH而可能发生的反应有( )
|
| A. | ①④⑥⑦ | B. | ③④⑤ | C. | ②③④⑤⑦ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
能用H++OH﹣=H2O来表示的化学反应是( )
A.氢氧化镁和稀盐酸反应 B.Ba(OH)2溶液滴入稀硫酸中
C.澄清石灰水和稀硝酸反应 D.二氧化碳通入澄清石灰水中
查看答案和解析>>
科目:高中化学 来源: 题型:
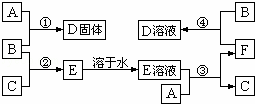
室温下,单质A、B、C分别为固体、黄绿色气体、无色气体.在合适反应条件下,它们可以按下面框图进行反应;又知单质A是当今世界产量最大的金属,E的溶液是无色的.请回答:
(1)A是Fe,B是Cl2,C是H2(请填写化学式);
(2)反应①的化学方程式 ;
(3)反应③的离子方程式 ;
(4)反应④的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
组成中有氢氧根的盐叫做碱式盐,酸根中含有氢元素的盐叫做酸式盐.下列盐中,既不是碱式盐又不是酸式盐的是( )
|
| A. | KHSO4 | B. | NH4NO3 | C. | Ca(H2PO4)2 | D. | Cu2(OH)2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
非金属单质A经下图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题:
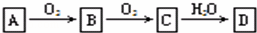
(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体.
①D的化学式是 ;
②在工业生产中,大量排放的B气体被雨水吸收后形成了 而污染环境.
(2)若A在常温下为气体,C是红棕色气体.
①A、C的化学式分别是:A ;C .
②D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的化学方程式 .该反应 (填“属于”或“不属于”)氧化还原反应.
查看答案和解析>>
科目:高中化学 来源: 题型:
(Ⅰ). 某溶液可能含有Cl-、SO42-、CO32-、
NH4+、Fe3+、Al3+和K+。取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红
褐色沉淀;过滤,洗涤,灼烧,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的
沉淀。(已知Al(OH)3可被NaOH溶液溶解)由此可知原溶液中:
(1)至少存在  种离子
种离子
(2)Cl- 是 存在(填“一定”“一定不”“可能”),c(Cl‑)范围是 mol/L(若存在Cl- 则计算并填写,若不存在或可能存在Cl-,则此空不填)
(3)写出产生红褐色沉淀的离子方程式:
(Ⅱ).实验室要用98%(ρ=1.84 g·cm-3)的硫酸配制3.68 mol·L-1的硫酸溶液500mL
(1)计算所需98%的硫酸 mL。
(2)要配制3.68mol·L-1的硫酸溶液500mL,准确量取一定体积的98%的硫酸后,还需用到的实验仪器是(填写序号): .
①量筒 ②烧杯 ③1000mL容量瓶 ④500mL 容量瓶 ⑤天平 ⑥胶头滴管 ⑦锥形瓶 ⑧玻璃棒
(3)若配制3.68mol·L-1的硫酸溶液的其他操作均正确,但出现下列错误操作,将例所配制的硫酸溶液浓度偏低的是 。
A.浓硫酸溶解后未冷却,直接转移至容量瓶后定容
B.将烧杯内的稀硫酸向容量瓶中转移时,因操作不当使部分稀硫酸溅出瓶外。
C.用量筒量取浓硫酸时,俯视读数
D.容量瓶使用前用含硫酸的溶液润洗了
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com