
【题目】对温室气体二氧化碳的研究一直是科技界关注的重点。
Ⅰ.在催化剂存在下用H2还原CO2是解决温室效应的重要手段之一,相关反应如下:
主反应:CO2(g)+4H2(g)CH4(g)+2H2O(g) ΔH1①
副反应:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1
已知:H2和CH4的燃烧热分别为285.5 kJ·mol-1和890.0 kJ·mol-1,H2O(l)===H2O(g) ΔH=+44 kJ·mol-1。
(1)ΔH1=________ kJ·mol-1。
(2)有利于提高CH4产率的反应条件是(至少写两条)______________________________工业上提高甲烷反应选择性的关键因素是________________________________。
(3)T℃时,若在体积恒为2 L的密闭容器中同时发生上述反应,将物质的量之和为5 mol的H2和CO2以不同的投料比进行反应,结果如图1所示。若a、b表示反应物的平衡转化率,则表示H2平衡转化率的是________,c、d分别表示CH4(g)和CO(g)的体积分数,由图1可知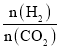 =________时,甲烷产率最高。若该条件下CO的产率趋于0,则T℃时①的平衡常数K=___________________。
=________时,甲烷产率最高。若该条件下CO的产率趋于0,则T℃时①的平衡常数K=___________________。
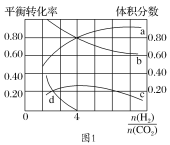
Ⅱ.溶于海水的CO2 95%以HCO3-形式存在。
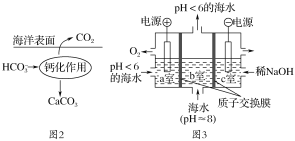
在海洋中,通过图2钙化作用实现碳自净。
(4)写出钙化作用的离子方程式________________。
(5)电解完成后,a室的pH________(填“变大”、“变小”或“几乎不变”);b室发生反应的离子方程式为________________________。
【答案】-164.0 降低温度、增大压强 催化剂 b 4 100 2HCO3-+Ca2+=CaCO3↓+CO2↑+H2O 几乎不变 H++HCO3-=CO2↑+H2O
【解析】
Ⅰ(1)根据盖斯定律解答;
(2)该主反应为气体分子数减小的放热反应,根据外界条件平衡移动的影响分析如何提高产率;
(3)结合图像曲线分析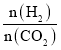 的比值,确定转化率,再利用“三段式”求解平衡常数;
的比值,确定转化率,再利用“三段式”求解平衡常数;
Ⅱ(4)由图2可知,HCO3-为反应物,CaCO3、CO2为生成物,据此分析书写离子反应方程式;
(5)a室为阳极室,阳极上发生氧化反应,电极反应式为2H2O-4e-=O2↑+4H+,阳离子向阴极移动,据此分析。
Ⅰ(1)由H2和CH4的燃烧热分别为285.5 kJ·mol-1和890.0 kJ·mol-1,可得:
①CO2(g)+4H2(g)CH4(g)+2H2O(g) ΔH1
②H2(g)+![]() O2(g)=H2O(l) ΔH=-285.5 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.5 kJ·mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.0 kJ·mol-1
④H2O(l)=H2O(g) ΔH=+44 kJ·mol-1
根据盖斯定律知,①=②×4-③+④×2,则ΔH1=(-285.5 kJ·mol-1)×4-(-890.0 kJ·mol-1)+(+44 kJ·mol-1)×2=-164.0 kJ·mol-1;
(2)该主反应为气体分子数减小的放热反应,故有利于提高CH4产率的反应条件是降低温度、增大压强。催化剂具有专一性,工业上提高甲烷反应选择性的关键因素是催化剂;
(3)随着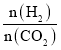 增大,H2的平衡转化率减小,CO2的平衡转化率增大,结合题图1可得,b表示H2的平衡转化率,a表示CO2的平衡转化率。c表示甲烷的体积分数,当
增大,H2的平衡转化率减小,CO2的平衡转化率增大,结合题图1可得,b表示H2的平衡转化率,a表示CO2的平衡转化率。c表示甲烷的体积分数,当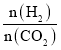 =4时,甲烷产率最高。
=4时,甲烷产率最高。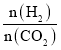 =4时,CO的产率趋于0,由题意并结合题图1得起始时c(CO2)=0.5 mol·L-1,c(H2)=2 mol·L-1,CO2、H2的平衡转化率均为0.80,则根据三段式法有:
=4时,CO的产率趋于0,由题意并结合题图1得起始时c(CO2)=0.5 mol·L-1,c(H2)=2 mol·L-1,CO2、H2的平衡转化率均为0.80,则根据三段式法有:
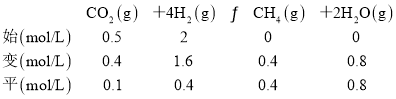
平衡常数K=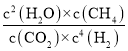 =
=![]() =100;
=100;
Ⅱ(4)由题图2可知,HCO![]() 为反应物,CaCO3、CO2为生成物,则钙化作用的离子方程式为2HCO
为反应物,CaCO3、CO2为生成物,则钙化作用的离子方程式为2HCO![]() +Ca2+=CaCO3↓+CO2↑+H2O;
+Ca2+=CaCO3↓+CO2↑+H2O;
(5)a室为阳极室,阳极上发生氧化反应,电极反应式为2H2O-4e-=O2↑+4H+,反应产生的H+通过质子交换膜进入b室参与反应生成CO2和H2O时进入阴极室与OH-也反应,所以电解后a室溶液的pH几乎不变,b室发生反应的离子方程式为H++HCO3-=CO2↑+H2O。


科目:高中化学 来源: 题型:
【题目】有X、Y、Z、Q、E、M、G原子序数依次增大的七种元素,除G元素外其余均为短周期主族元素。X元素原子中没有成对电子,Y元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子数相同,Z元素原子的价电子排布式为![]() ,Q元素基态原子核外成对电子数足未成对电子数的 3倍,E与Q位于同周期,M元素的第一电离能在 同周期主族元素中排第三位,G元素原子的价电子 排布式为
,Q元素基态原子核外成对电子数足未成对电子数的 3倍,E与Q位于同周期,M元素的第一电离能在 同周期主族元素中排第三位,G元素原子的价电子 排布式为![]() 。回答下列问题:
。回答下列问题:
(1)写出第3周期基态原子未成对电子数与G的相同且电负性最大的元素: ___________ (填元素名称)。GQ受热分解生成![]() 和
和![]() ,请从G的原子结构来说明
,请从G的原子结构来说明![]() 受热易分解的原因: ______ 。
受热易分解的原因: ______ 。
(2) Z、Q、M三种元素的第一电离能由大到小的顺序为 _________ (用元素符号表示)。
(3) Y与Q形成原子个数比为1:2的化合物的电子式为 _________ 。
(4) Z、M、E所形成的简单离子的半径由大到小的顺序为 __________ (用离子符号表示)。
(5) X、Y、Z、Q的电负性由大到小的顺序为 _______ (用元素符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.NH3中氮原子的杂化方式为sp3杂化
B.[Cu(NH3)4]2+中,NH3是配体
C.NH4+、PH4+、CH4、BH4-互为等电子体
D.NH3的沸点比PH3的沸点低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某无机化合物的二聚分子结构示意图,该分子中A、B两种元素都是第3周期的元素,分子中所有原子的最外层都达到8个电子的稳定结构。下列说法不正确的是( )
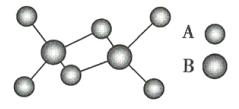
A.该物质的化学式是Al2Cl6B.该物质是离子化合物,在熔融状态下能导电
C.该物质在固态时所形成的晶体是分子晶体D.该物质中不存在离子键,也不含有非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】β-氮化碳的硬度超过金刚石晶体,成为首屈一指的超硬新材料,已知该氮化碳的二维晶体结构如图所示。下列说法不正确的是( )
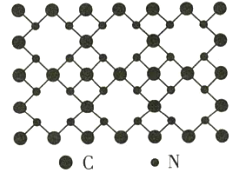
A.该晶体中的碳、氮原子都满足8电子稳定结构
B.该晶体中碳显+4价,氮显-3价
C.该晶体中每个碳原子与四个氮原子相连,每个氮原子与三个碳原子相连
D.该晶体的分子式为C3N4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类比推理是化学中常用的思维方法。下列推理正确的是
A.lmol晶体硅含Si-Si键的数目为2NA,则1mol金刚砂含C-Si键的数目也为2NA
B.Ca(HCO3)2溶液中加入过量的NaOH溶液,发生化学反应的方程式:![]()
则Mg(HCO3)2溶液中加入过量的NaOH溶液,发生化学反应的方程式: ![]()
C.标准状况下,22.4 L CO2中所含的分子数目为NA个,则22.4 LCS2中所含的分子数目也为NA个
D.NaClO溶液中通人过量CO2发生了反应:![]() ,则Ca(ClO)2溶液中通入过量CO2发生了:
,则Ca(ClO)2溶液中通入过量CO2发生了:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及其化合物的应用广泛。试回答下列问题:
(1)基态![]() 原子的价电子轨道表示式为__________,其第一电离能比
原子的价电子轨道表示式为__________,其第一电离能比![]() 的__________(填“大”或“小”)。
的__________(填“大”或“小”)。
(2)氨硼烷(![]() )被认为是最具潜力的新型储氢材料之一,分子中存在配位键,提供孤电子对的原子是__________,写出一种与氨硼烷互为等电子体的有机小分子:___________________(填化学式)。
)被认为是最具潜力的新型储氢材料之一,分子中存在配位键,提供孤电子对的原子是__________,写出一种与氨硼烷互为等电子体的有机小分子:___________________(填化学式)。
(3)常温常压下硼酸(![]() )的晶体结构为层状,其二维平面结构如图所示。
)的晶体结构为层状,其二维平面结构如图所示。
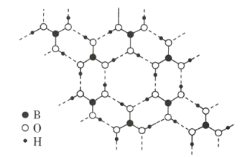
①B原子的杂化方式为__________。从氢键的角度解释硼酸在冷水中的溶解度小而加热时溶解度增大: _________________。
②路易斯酸碱理论认为,任何可接受电子对的分子或离子叫路易斯酸,任何可给出电子对的分子或离子叫路易斯碱。从结构角度分析硼酸是路易斯酸:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯分子中不存在碳碳单键和碳碳双键的交替结构,下列可以证明该结论的事实是( )
①苯不能使酸性![]() 溶液褪色 ②苯分子中碳碳键的键长完全相等 ③苯能在加热和催化剂存在的条件下与氢气发生反应生成环己烷 ④经实验测得对二甲苯只有一种结构 ⑤苯在溴化铁作催化剂条件下与液溴可发生取代反应,但不能因发生化学反应而使溴水褪色
溶液褪色 ②苯分子中碳碳键的键长完全相等 ③苯能在加热和催化剂存在的条件下与氢气发生反应生成环己烷 ④经实验测得对二甲苯只有一种结构 ⑤苯在溴化铁作催化剂条件下与液溴可发生取代反应,但不能因发生化学反应而使溴水褪色
A.②③④B.②④⑥C.①②⑤D.①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氨基酸中含C、N、H、O四种元素,已知除氢原子外,其他原子均达到最外层8电子的稳定结构。如图为该氨基酸分子的球棍模型:
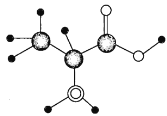
(1)氨基酸是_________(填“淀粉”“纤维素”“蛋白质”或“油脂”)完全水解的产物,该氨基酸的结构简式为__________。
(2)该氨基酸中含氧官能团的名称是____________。
(3)在浓硫酸、加热的条件下,该氨基酸与乙醇发生酯化反应的化学方程式为______。
(4)互为同系物的有机物具有相同的官能团,与该氨基酸互为同系物且少一个碳原子的氨基酸的结构简式为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com